

分析 (1)合成氨反应是一个体积减小的反应,可以得出随着压强的增大,平衡向氨气增大的方向移动,结合图象可以知道b符合要求.又因为合成氨反应是一个放热反应,可以得出随着温度的升高,平衡向氨气减少的方向移动,结合图象可以知道a符合要求.
(2)要求三个容积相同的容器①、②、③,若起始温度相同,分别向三个容器中充入3mol H2和1mol N2,一定条件下反应,可以知道①是恒温,合成氨是一个放热反应,因此①相当于外界对体系加热,因此加热平衡向氨气减少的方向移动,③活塞可以自由的移动,和外界的大气压强始终保持一致,因合成氨反应是一个压强减少的反应,所以保持压强不变,相当于对体系加压,所以平衡向氨气生成的方向移动.
解答 解:(1)工业合成氨为N2+3H2$?_{高温高压}^{催化剂}$2NH3 △H<0 增大压强时平衡向右进行,氨气的百分含量增大,因△H<0,为放热反应,增加温度,平衡向逆反应方向移动,氨气的百分含量减少,故答案为:b;a;
(2)以②为基准,①外有隔热套,相当于在②基础上加热平衡向逆反应方向移动,氨气的百分含量减少.③是恒压状态,相当于在②基础上加压,平衡向右进行,氨气的百分含量增大.所以NH3物质的百分含量由大到小的顺序为①<②<③,
故答案为:①<②<③.
点评 本题主要考查影响平衡移动的因素和等效平衡原理,难度不大.


 教材全解字词句篇系列答案
教材全解字词句篇系列答案科目:高中化学 来源: 题型:选择题
| A. | 氢气的燃烧热为285.8 kJ/mol,则水电解的热化学方程式为:2H2O(l)=2H2(g)+O2(g)△H=+285.8 kJ/mol | |
| B. | 1 mol甲烷完全燃烧生成CO2和H2O(l)时放出890kJ热量,则甲烷的燃烧热化学方程式为:$\frac{1}{2}$CH4(g)+O2(g)=$\frac{1}{2}$CO2 (g)+H2O(l)△H=-445 kJ/mol | |
| C. | HF与NaOH溶液反应:H+(aq)+OH-(aq)=H2O(l)△H=-57.3 kJ/mol | |
| D. | 由石墨比金刚石稳定可知:C(金刚石,s)=C(石墨,s)△H<0 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
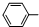 )
)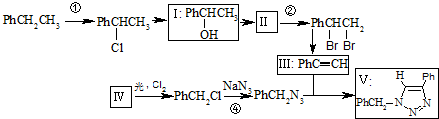
 (不要求写出反应条件).
(不要求写出反应条件).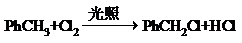 (要求写出反应条件).
(要求写出反应条件).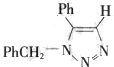 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向水中加入少量固体硫酸氢钠,c(H+)增大,KW不变 | |
| B. | 向水中加入稀氨水,平衡逆向移动,c(OH-)降低 | |
| C. | 向水中加入稀硫酸,c(H+)增大,水的电离程度增大 | |
| D. | 95℃纯水的pH<7,说明加热可导致水呈酸性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cl2和H2O2都能使品红溶液褪色 | |
| B. | 漂白粉和亚硫酸钠固体长期暴露在空气中变质 | |
| C. | 浓硝酸和氯水用棕色试剂瓶保存 | |
| D. | SO2和Na2SO3溶液都能使溴水褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com