
【题目】工业上采用硫铁矿焙烧去硫后的烧渣(主要成分为Fe2O3、FeO、SiO2、Al2O3,不考虑其他杂质)制取七水合硫酸亚铁(FeSO4·7H2O),流程如下:

(1)滤渣I的主要成分是_______________(填化学式)。
(2)还原时,试剂X若选用SO2,则反应后溶液中的阴离子是_________________(填化学式)
(3)检验过滤Ⅰ得到的滤液中存在Fe3+的方法是____________________。
(4)七水合硫酸亚铁(FeSO4·7H2O)在医学上常用作补血剂。某课外小组通过以下实验方法测定某补血剂中亚铁离子的含量。
步骤a:取10片补血剂样品除去糖衣、研磨、溶解、过滤,将滤液配成250mL溶液;
步骤b:取上述溶液25 mL于锥形瓶中,加入少量稀硫酸酸化后,逐渐滴加0.0100 mol/L的KMnO4溶液,至恰好完全反应,记录消耗的KMnO4溶液的体积(假定药品中其他成分不与KmnO4反应),发生的反应为:MnO4-+5Fe2++8H+=5Fe3++Mn2++4H2O;
步骤c:重复“步骤b”2~3次,平均消耗KMnO4溶液20.00mL。
①步骤a中配制溶液时需要的玻璃仪器除烧杯、胶头滴管外,还需要___________、________。
②该补血剂中亚铁离子的含量为mg/片(请写出计算过程) ___________。
【答案】 SiO2 SO42- 取少量过滤Ⅰ得到的滤液于试管中,向其中加入几滴KSCN溶液,若溶液出现血红色,则说明滤液中含有Fe3+ 玻璃棒 250 mL容量瓶 MnO4-~5Fe2+
25mL溶液中:n(Fe2+) = 5n(MnO4-) = 5×0.0100mol/L×20.00×10-3=10-3mol
250mL溶液中:n(Fe2+)=10-3mol×10 =10-2mol
1片补血剂样品中:n(Fe2+)=10-3mol
m(Fe2+)=10-3mol×56g/mol=56mg
【解析】烧渣中加入稀硫酸,得到硫酸铁、硫酸亚铁和硫酸铝,二氧化硅不反应,过滤,滤渣Ⅰ为二氧化硅,在滤液中加入试剂X,还原硫酸铁得到硫酸铝和硫酸亚铁溶液,调节溶液pH,生成氢氧化铝沉淀,滤渣Ⅱ为氢氧化铝,溶液经蒸发结晶、过滤、洗涤、干燥,可得到FeSO47H2O,则
(1)二氧化硅不与稀硫酸反应,滤渣1为二氧化硅,化学式为SiO2;(2)试剂X若选用SO2,发生反应:SO2+2Fe3++2H2O=SO42-+2Fe2++4H+,则阴离子为SO42-;(3)检验铁离子一般利用KSC溶液,即取少量过滤Ⅰ得到的滤液于试管中,向其中加入几滴KSCN溶液,若溶液出现血红色,则说明滤液中含有Fe3+;(4)①配制250mL溶液需要的玻璃仪器有烧杯、胶头滴管、玻璃棒、250 mL容量瓶;②根据方程式可知MnO4-~5Fe2+,25mL溶液中:n(Fe2+)=5n(MnO4-)=5×0.0100mol/L×0.02L=10-3mol,250mL溶液中:n(Fe2+)=10-3mol×10=10-2mol,因此1片补血剂样品中:n(Fe2+)=10-3mol,所以m(Fe2+)=10-3mol×56g/mol=0.056g=56mg。


 同步拓展阅读系列答案
同步拓展阅读系列答案科目:高中化学 来源: 题型:
【题目】下图是某学校实验室从化学试剂商店买回的浓硫酸试剂标签上的部分内容。现用该浓硫酸配制480 mL、 1 mol/L的稀硫酸。可供选用的仪器有:①烧瓶②烧杯③玻璃棒④药匙⑤量筒

请回答下列问题:
(1)该浓硫酸的物质的量浓度为____________ mol/L。
(2)配制稀硫酸时,上述仪器中不需要的仪器是____________(填序号),还缺少的仪器有______________________________ (填写仪器名称)。
(3)经计算,配制480mL、1mol/L的稀硫酸需要用量筒量取上述浓硫酸的体积为______ mL,量取浓硫酸所用的量筒的规格是________。
(从下列规格中选用: 10 mL 、 25 mL 、 50 mL 、100 mL)
(4)对所配制的稀硫酸进行测定,发现其浓度大于1mol/L,配制过程中下列各项操作可能引起该误差的原因有____________。
A.定容时,俯视容量瓶刻度线进行定容
B.在烧杯中将浓硫酸进行稀释后立即转入容量瓶中
C.转移溶液时,不慎有少量溶液洒到容量瓶外面
D.容量瓶用蒸馏水洗涤后未干燥,含有少量蒸馏水
E.定容摇匀后发现液面低于刻度线,再加蒸馏水至刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在实验室中有下列四组试剂,某同学欲分离含有氯化钾、氯化铁和硫酸钡的混合物,应选用的试剂组合是( )
A. 水、硝酸银溶液、稀硝酸 B. 水、氢氧化钾溶液、硫酸
C. 水、氢氧化钠溶液、稀盐酸 D. 水、氢氧化钾溶液、盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,CH4与H2O(g)发生反应:CH4(g)+H2O(g)CO(g)+3H2(g)设起始 ![]() =Z,在恒压下,平衡时CH4的体积分数φ(CH4)与Z和T(温度)的关系如图所示,下列说法错误的是( )
=Z,在恒压下,平衡时CH4的体积分数φ(CH4)与Z和T(温度)的关系如图所示,下列说法错误的是( ) 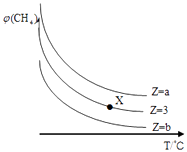
A.该反应的焓变△H>0
B.图中Z的大小为b>3>a
C.图中X点对应的平衡混合物中 ![]() =3
=3
D.温度不变时,图中X点对应的平衡在加压后φ(CH4)增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用化学方程式解释下列问题:
(1)实验室不用石英坩埚熔化NaOH固体: _________。
(2)漂白粉露置于空气中较长时间后失效: _________。
(3)Fe(OH)2暴露在空气中最后变成红褐色固体: _________。
(4)等物质的量的SO2与Cl2同时通入水中,溶液无漂白性:_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质的类别和核心元素的化合价是研究物质性质的两个重要角度。请根据下图,回答下列问题:
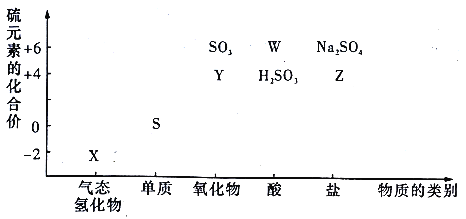
(1)检验Y所用的试剂是_________。
(2)W的稀溶液与铁反应的离子方程式为_________。
(3)欲制备Na2S2O3,从氧化还原角度分析,合理的是_________(填标号)。
a.Na2S+S b.Na2SO3+S c.Na2SO3+Na2SO4 d.SO2+Na2SO4
(4)将X与Y的溶液混合,现象为_________,该反应的氧化剂与还原剂的物质的量之比为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】两种气态烃组成的混和气体0.1mol完全燃烧得0.16摩尔CO2和3.6gH2O,下列说法正确的( )
A. 一定有乙烯B. 一定是甲烷和乙烯
C. 一定有乙炔D. 一定有甲烷
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】废旧显示屏玻璃中含有SiO2、Fe2O3、CeO2、FeO等物质.某课题小组以此玻璃粉末为原料,制得Ce(OH)4和硫酸铁铵矾,流程设计如下: 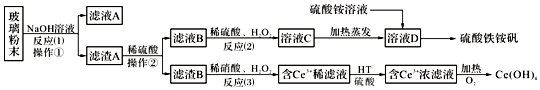
已知:Ⅰ、酸性条件下,铈在水溶液中有Ce3+、Ce4+两种主要存在形式,Ce4+有较强氧化性;
Ⅱ、CeO2不溶于稀硫酸,也不溶于氢氧化钠溶液.
回答以下问题:
(1)操作①的名称是;该操作所用的玻璃仪器有:烧杯、、 .
(2)反应(2)中过氧化氢的作用是: .
(3)反应(3)的离子方程式是:
(4)已知有机物HT能将Ce3+从水溶液中萃取出来,该过程可表示为:2Ce3+(水层)+6HT(有机层)2CeT3(有机层)+6H+(水层)从平衡角度解释:向CeT3(有机层)加入硫酸获得较纯的含Ce3+的水溶液的原因是 .
(5)硫酸铁铵矾广泛用于水的净化处理,其净水原理用离子方程式表示为:
(6)相同物质的量浓度的以下四种溶液中,铵根离子浓度由大到小的顺序是: .
a.xFe2(SO4)3y(NH4)2SO4zH2Ob.(NH4)2SO4c.(NH4)2CO3d.NH3H2O
(7)为测定某硫酸铁铵矾样品的组成,现称取14.00g该样品,将其溶于水配制成100mL溶液;再将溶液分成两等份,向其中一份加入足量氢氧化钠溶液,过滤、洗涤沉淀、再烘干灼烧至恒重,得到1.60g固体;向另一份溶液中加入0.5mol/L硝酸钡溶液100mL,恰好完全反应.则该硫酸铁铵矾的化学式为 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com