
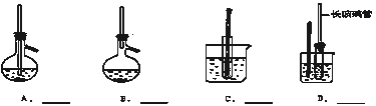
【题目】A~D是中学化学实验中常见的几种温度计装置示意图.
①酒清和浓硫酸混合加热制乙烯
②电石跟水反应制乙炔
③分离苯和硝基苯的混合物
④苯和溴的取代反应
⑤石油的分馏实验
⑥浓盐酸和二氧化锰混合加热制氯气
⑦测定硝酸钾在水中溶解度
⑧食盐和浓硫酸混合加热制氯化氢
⑨苯的硝化反应
(1)请从①~⑧中选出必须使用温度计的实验,把编号填入最适宜的装置图A~C的空格中。A________B________C________D________
(2)下列括号内的物质为所含的少量杂质,请选用适当的试剂和分离装置将杂质除去。
试剂:a.水,b.氢氧化钠,c.食盐,d.溴水,e.生石灰,f.溴的四氯化碳溶液
分离装置:A.分液装置,B.过滤装置,C.蒸馏装置,D.洗气装置
1﹣氯丙烷(乙醇)_____;乙烷(乙烯)_____;苯(苯酚)____;溴化钠溶液(碘化钠)____。
【答案】 ① ③⑤ ⑦ ⑨ a﹣A d﹣D b﹣A f﹣A
【解析】
(1)根据需要控制温度及控制温度的部位解答;(2)一氯丙烷和乙醇互溶,但乙醇易溶于水,一氯丙烷不易溶于水,可以选用水作除杂剂,然后采用分液方法分离;乙烷性质较稳定、乙烯易和溴发生加成反应,所以可以用溴水除去乙烯;苯和苯酚互溶,但苯酚易和NaOH溶液反应、苯和氢氧化钠溶液不反应,溶液采用分液方法分离;碘化钠和溴发生氧化反应生成溴化钠和碘,反应采用分液方法分离
(1)①实验室制乙烯温度控制170度,温度计水银球在反应物液面下,对应A;②电石跟水反应制乙炔,不需要加热;③利用沸点不同,通过加热,控制蒸汽温度,分馏各组分,温度计水银球在蒸馏烧瓶支管口处,对应为B;④苯和溴的取代反应,不需要加热;⑤利用沸点不同,通过加热,控制蒸汽温度,分馏各组分,温度计水银球在蒸馏烧瓶支管口处,对应为B;⑥浓硫酸和二氧化锰混合加热制氯气,不需要控制温度;⑦测定硝酸钾在水中的溶解度,要控制移动温度,温度计水银球在液面下,对应为C;⑧盐和浓硫酸混合加热制氯化氢,不需要控制温度;⑨苯的硝化反应需要控制水浴温度。故答案为:A①;B③⑤;C ⑦;D⑨;(2)一氯丙烷和乙醇互溶,但乙醇易溶于水,一氯丙烷不易溶于水,可以选用水作除杂剂,一氯丙烷和水不互溶,所以可以采用分液方法分离,故选a﹣A;乙烷性质较稳定、乙烯易和溴发生加成反应,所以可以用溴水除去乙烯,采用洗气装置除杂,故选d﹣D;苯和苯酚互溶,但苯酚易和NaOH溶液反应、苯和氢氧化钠溶液不反应,苯和水混合分层,所以混合溶液采用分液方法分离,故选b﹣A;碘化钠和溴发生氧化反应生成溴化钠和碘,碘不易溶于水,所以反应后用分液方法分离,故选f﹣a。


科目:高中化学 来源: 题型:
【题目】环己烯粗品中含有环己醇和少量酸性杂质等。加入饱和食盐水,振荡、静置、分层,环己烯在_________层(填"上"或"下"),分液后再用_________洗涤(填入编号)。已知:
密度(g/cm3) | 熔点(℃) | 沸点(℃) | 溶解性 | |
环己醇 | 0.96 | 25 | 161 | 能溶于水 |
环己烯 | 0.81 | -103 | 83 | 难溶于水 |
A.KMnO4溶液 B.稀H2SO4 C. Na2CO3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(题文)为了探究三种气态氧化物(SO2、NO2、CO2)的性质,某同学设计了一组实验:
(1)实验一:探究三种气体在水中的溶解性,用三支相同的试管收集满三种气体,倒置在盛满水的烧杯中,一段时间后,观察到的现象如图A,B,C所示。
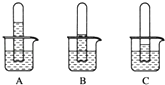
(i)在相同条件下,三种气体在水中溶解度最大的是_____,写出A烧杯中发生反应的化学方程式:________。
(2)实验二:用三只集气瓶收集满二氧化硫、二氧化氮气体,然后将其倒置在水槽中.分别缓慢通入适量O2或Cl2,如图D,E,F所示.一段时间后,D,E装置的集气瓶中充满溶液,F装置的集气瓶中还有气体剩余。
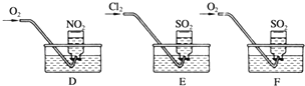
(ii)实验二中装置D的集气瓶最终充满溶液(假设瓶内液体不扩散):
①写出装置D中总反应的化学方程式:________。
②假设该实验条件下,气体摩尔体积为aLmol﹣1,则装置D的集气瓶中所得溶液溶质的物质的量浓度为_____。
(iii)实验前在F装置的水槽里滴加几滴紫色石蕊试液,观察到的现象是________,通入氧气后,可能观察到的实验现象是________,写出反应的化学方程式:________。
(iv)溶液充满集气瓶后,在E装置的水槽里滴加硝酸钡溶液,写出有关反应的离子方程式________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生的实验报告所列出的下列数据中合理的是( )
A. 用酸式滴定管量取13.17mL稀盐酸
B. 用10mL量筒量取7.13mL稀盐酸
C. 用广泛pH试纸测得某溶液的pH为2.3
D. 用天平称取物品的质量为5.872g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属铝在生产生活中有广泛用途。
(1)铝元素在元素周期表中位于______________。
(2)用化学方程式表示工业制备铝单质______________。 铝热反应可用于焊接钢轨,下图为铝热反应的实验装置图。

(3) 该铝热反应的化学方程式是______________。铝热反应的反应现象说明反应物的总能量___________生成物的总能量(填“<”、“>”或“=”)。
(4)铝热反应在工业上用于冶炼______________金属(填编号)。
A. 强还原性 B. 难熔性 C. 易导电 D. 活泼
(5)反应结束后,从沙中取出生成的固体物质,有同学推测该固体是铁铝合金,他设计了如下实验证明此 固体中含有金属铝:取少量固体于试管中,滴加______________,当观察到______________现象时,证明固体中含有金属铝。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X、Y、Z、W四种短周期元素的原子序数依次增大,其中X与Y、Z、W所形成的常见化合物(10e或18e)在常温下均为气态,在元素周期表中Z与W相邻,Y的最高价氧化物的水化物与其氢化物反应生成盐,且Y的核电荷数与W的外成层电子数相同。
(1)Z离子的结构示意图是_____________________________。
(2)X、Y、W可组成一种化合物,原子个数比为4:1:1,该化合物的化学式是_______,其中含有的化学键有__________________。
(3)X与Y所形成的分子的电子式为__________,它比同主族其他元素的氢化物沸点高的原因是__________________。
(4)请从Z、W的结构上说明Z、W两种元素非金属性的强弱_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】今有一混合物的水溶液,只可能含有以下离子中的若干种:Na+、NH4+、Mg2+、Ba2+、CO32﹣、SO42﹣、Cl﹣,现取三份100mL溶液进行如下实验:根据上述实验,以下推测正确的是( )
(1)第一份加入AgNO3溶液有沉淀产生
(2)第二份加足量KOH溶液加热后,收集到气体0.08mol
(3)第三份加足量BaCl2溶液后,得干燥沉淀12.54g,经足量盐酸洗涤、干燥后,沉淀质量为4.66g.
A. Na+一定存在
B. 100mL溶液中含0.01mol CO32﹣
C. Cl﹣一定存在
D. Ba2+一定不存在,Mg2+可能存在
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上常以烃的含氧衍生物X为主要原料生产可降解塑料PCL{![]() }及阻燃剂四溴双酚A.合成线路如下:
}及阻燃剂四溴双酚A.合成线路如下:
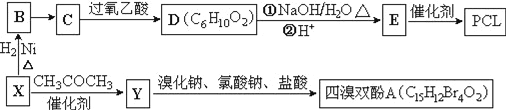
已知:①X的蒸汽密度是相同条件下H2的47倍,遇FeCl3溶液显紫色;C为![]() 。
。
②![]() 。
。
③RCOCH2R′![]() RCOOCH2R′。
RCOOCH2R′。
(1)B的名称是_________________。
(2)B→C还需要的反应试剂及条件是___________。C→D的反应类型是______________________。
(3)写出X→Y的化学方程式:_______________________________。
(4)0.5mol四溴双酚A在一定条件下与足量的NaOH溶液反应,最多消耗__molNaOH。
(5)符合以下条件的D的同分异构体有__种(不考虑空间异构)。
①含有两个甲基和两种官能团 ②能使溴的CCl4溶液褪色 ③能发生银镜反应
(6)已知由烯烃直接制备不饱和酯的新方法为:
![]()
利用乙烯为有机原料(无机物和反应条件自选)合成聚合物涂料![]() ,写出合成该涂料的反应流程图:________________________________。
,写出合成该涂料的反应流程图:________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙、丙、丁、戊五种物质中,甲、乙、丙中均含有某种相同的元素,它们之间具有如下图所示转化关系(反应条件及部分产物已略去)。下列有关物质的推断不正确的是

选项 | 假设 | 结论 |
A | 甲为S | 戊可能是氧气 |
B | 甲为Al(OH)3 | 丁可能是氢氧化钠溶液 |
C | 甲为Fe | 丁可能是硝酸 |
D | 甲为Na2CO3溶液 | 戊可能是CO2 |
A. A B. B C. C D. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com