
【题目】将铁粉和活性炭混合物用NaCl溶液湿润,进行铁的电化学腐蚀实验(装置如图所示)。下列有关该实验的说法正确的是( )
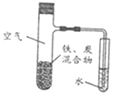
A.负极反应式为Fe-3e-=Fe3+
B.铁腐蚀过程中化学能全部转化为电能
C.用水代替NaCl溶液,铁不能发生吸氧腐蚀
D.用稀醋酸代替NaCl溶液,最终导管中的液面会上升
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述相符的是( )
A. 图1表示常温下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则等物质的量浓度的NaA和NaB混合溶液中:c(Na+)>c(A-)>c(B-)>c(OH-)>c(H+)
图1表示常温下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则等物质的量浓度的NaA和NaB混合溶液中:c(Na+)>c(A-)>c(B-)>c(OH-)>c(H+)
B.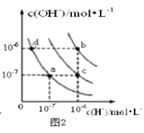 图2中在b点对应温度下,将pH=2的H2SO4溶液与pH=12的NaOH溶液等体积混合后,溶液显中性
图2中在b点对应温度下,将pH=2的H2SO4溶液与pH=12的NaOH溶液等体积混合后,溶液显中性
C.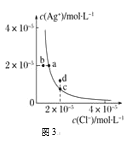 图3中d点没有AgCl沉淀生成
图3中d点没有AgCl沉淀生成
D.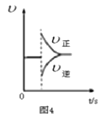 图4表示在N2(g)+3H2(g)
图4表示在N2(g)+3H2(g)![]() 2NH3(g)达到平衡后,减小NH3浓度时速率的变化
2NH3(g)达到平衡后,减小NH3浓度时速率的变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下列实验装置进行相应实验,能达到实验目的的是
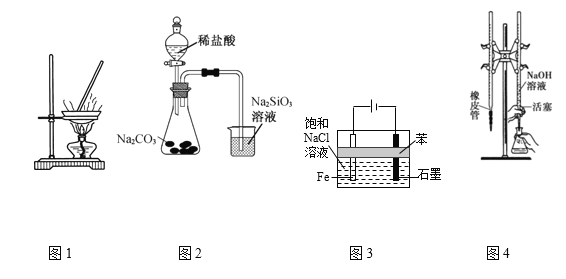
A.用图1装置蒸发CuCl2溶液获得无水CuCl2
B.用图2装置可证明非金属强弱:Cl>C>Si
C.用图3装置制备少量白色的Fe(OH)2沉淀
D.用图4装置进行已知浓度的NaOH溶液测定未知浓度的盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以活性炭为催化剂,可以将工业废气中的SO2催化氧化变为硫酸,进而制得各种硫酸盐,如硫酸亚铁铵[(NH4)2SO4·FeSO4·6H2O]等。
(1)研究表明,SO2在活性炭上催化氧化的反应机理可以表示为(*标记的为吸附状态)
Ⅰ.二氧化硫的吸附:SO2(g)![]() SO2* ΔH1=a kJ·mol-1
SO2* ΔH1=a kJ·mol-1
Ⅱ.氧气的吸附:O2(g)![]() 2O* ΔH2=b kJ·mol-1
2O* ΔH2=b kJ·mol-1
Ⅲ.三氧化硫的氧化:SO2*+O*=SO3* ΔH3=c kJ·mol-1
Ⅳ.三氧化硫的脱附:SO3*![]() SO3(g) ΔH4=d kJ·mol-1
SO3(g) ΔH4=d kJ·mol-1
根据上述反应机理,写出SO2在活性炭上催化氧化的热化学方程式____。
(2)以硫酸亚铁铵[(NH4)2SO4·FeSO4·6H2O]为原料通过下列流程可以制备晶体A。

①已知25 ℃时,[Fe(C2O4)3]3-(aq)+SCN-(aq)![]() [Fe(SCN)]2+(aq)+3C2O42-(aq),K=10-16。某研究小组同学欲检验晶体A中含有三价铁,取少量晶体放入试管中,用蒸馏水充分溶解,向试管中滴入几滴0.1 mol·L-1KSCN溶液。请判断上述实验方案是否可行并说明理由:____。
[Fe(SCN)]2+(aq)+3C2O42-(aq),K=10-16。某研究小组同学欲检验晶体A中含有三价铁,取少量晶体放入试管中,用蒸馏水充分溶解,向试管中滴入几滴0.1 mol·L-1KSCN溶液。请判断上述实验方案是否可行并说明理由:____。
②某研究小组通过如下实验步骤测定晶体A的化学式:
步骤1:准确称取A样品4.910 0 g,干燥脱水至恒重,残留物质量为4.370 0 g;
步骤2:准确称取A样品4.910 0 g置于锥形瓶中,加入足量的3.000 mol·L-1 H2SO4溶液和适量蒸馏水,用0.500 0 mol·L-1 KMnO4溶液滴定,当MnO4-恰好完全被还原为Mn2+时,消耗KMnO4溶液的体积为24.00 mL;(C2O42-+MnO4-+H+→CO2↑+Mn2++H2O)
步骤3:将步骤1所得固体溶于水,加入铁粉0.280 0 g,恰好完全反应。
通过计算确定晶体A的化学式(写出计算过程)。_____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在给定条件下,下列选项中所示物质间的转化均能实现的是( )
A.CH3CH2CH2Br![]() CH3CH=CH2
CH3CH=CH2![]() CH3CHBrCH2Br
CH3CHBrCH2Br
B.NaOH(aq)![]() C6H5ONa(aq)
C6H5ONa(aq)![]() NaHCO3(aq)
NaHCO3(aq)
C.NaOH(aq)![]() Cu(OH)2浑浊液
Cu(OH)2浑浊液![]() Cu2O(s)
Cu2O(s)
D.石油![]() CH3CH=CH2
CH3CH=CH2![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用铝土矿(主要成分为Al2O3,含Fe2O3等杂质)为原料冶炼铝的工艺如图:
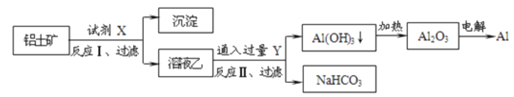
对上述流程判断正确的是( )
A.试剂X为稀硫酸或氢氧化钠溶液
B.反应II中生成Al(OH)3的反应为CO2+AlO2-+2H2O→Al(OH)3↓+HCO3-
C.结合质子(H+)的能力由强到弱的顺序是AlO2->OH->CO32->HCO3-
D.Al2O3熔点很高,工业上还可采用点解熔融AlCl3冶炼Al
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定量的CO2与足量的碳在体积可变的恒压密闭容器中反应:C(s)+CO2(g)![]() 2CO(g)。平衡时,体系中气体体积分数与温度的关系如图所示。已知:气体分压(p分)=气体总压(p总)×体积分数。下列说法正确的是( )
2CO(g)。平衡时,体系中气体体积分数与温度的关系如图所示。已知:气体分压(p分)=气体总压(p总)×体积分数。下列说法正确的是( )
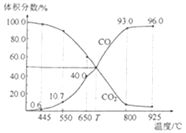
A.550℃时,若充入稀有气体,v正、v逆均减小,平衡不移动
B.T℃时,反应达平衡后CO2的转化率为50%
C.T℃时,若充入等体积的CO2和CO,平衡不移动
D.925℃时,用平衡分压代替平衡浓度表示的化学平衡常数Kp=24.0p总
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于元素金属性、非金属性的说法正确的是( )
A.![]() 的酸性强于
的酸性强于![]() ,故非金属性:
,故非金属性:![]()
B.第ⅠA族金属元素是同周期中金属性最强的元素
C.仅用![]() 溶液、
溶液、![]() 溶液、
溶液、![]() 溶液,无法验证
溶液,无法验证![]() 、
、![]() 的金属性强弱
的金属性强弱
D.第ⅦA族元素的阴离子还原性越强,其最高价氧化物对应水化物的酸性越强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向等物质的量浓度的NaOH和Na2CO3的混合溶液中加入稀盐酸.下列离子方程式可能与事实相符的是
A.OH﹣+2CO32﹣+3H+→2HCO3﹣+H2O
B.2OH﹣+CO32﹣+3H+→HCO3﹣+2H2O
C.2OH﹣+CO32﹣+4H+→CO2↑+3H2O
D.OH﹣+CO32﹣+3H+→CO2↑+2H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com