
【题目】功能高分子材料M( ![]() )具有化学反应活性、光敏性、生物相容性等特点。下面是合成M的流程:
)具有化学反应活性、光敏性、生物相容性等特点。下面是合成M的流程:
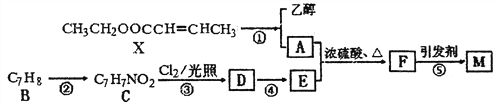
(1)物质C的名称为____________;物质M的分子式为______________。
(2)写出反应①的化学方程式______________________________________。
(3)反应④的反应条件是__________反应①至⑤,5个反应中属于取代反应的有_____个。
(4)有机物N的分子式为C5H8O2,该有机物存在多种同分异构体,其中同时符合以下条件的有_____种。
①与有机物X互为同系物;②碳碳双键上连有羟基不稳定,不考虑此类醇形成酯的结构。
(5)已知:![]()
设计一条以乙醇为原料制备有机物X的合成路线(无机试剂任选)。____________________________。
【答案】 对硝基甲苯 (C11H11NO4)n ![]() NaOH水溶液 4 9
NaOH水溶液 4 9 

【解析】根据流程图,X酯水解生成乙醇和A,A为CH3CH=CHCOOH,根据M( ![]() )可知F为
)可知F为![]() ,则E为
,则E为![]() ;根据B的分子式,结合E的结构可知B为甲苯,根据C的分子式知,反应②为甲苯的硝化反应,C为对硝基甲苯,反应③为C中苯环侧链的取代反应生成D,D水解生成E。
;根据B的分子式,结合E的结构可知B为甲苯,根据C的分子式知,反应②为甲苯的硝化反应,C为对硝基甲苯,反应③为C中苯环侧链的取代反应生成D,D水解生成E。
(1)根据上述分析,物质C为对硝基甲苯;物质M的分子式为(C11H11NO4)n,故答案为:对硝基甲苯;(C11H11NO4)n;
(2)反应①为X的水解反应,反应的化学方程式为![]() ,故答案为:
,故答案为:![]() ;
;
(3)反应④为卤素原子的水解反应,反应的条件为NaOH水溶液;反应①至⑤,①为水解反应,属于取代反应,②为硝化反应,属于取代反应,③为苯环侧链的取代反应,④为素原子的水解反应,属于取代反应,⑤为加聚反应,5个反应中属于取代反应的有4个,故答案为:NaOH水溶液;4;
(4)有机物N的分子式为C5H8O2,①与有机物X互为同系物,说明结构中含有酯基和碳碳双键;②碳碳双键上连有羟基不稳定,不考虑此类醇形成酯的结构。满足条件的N的同分异构体有CH3OOCCH=CHCH3、CH3OOCCH2CH=CH2、CH3OOCC(CH3)=CH2、HCOOCH2CH=CHCH3、HCOOCH2CH2CH=CH2、HCOOCH(CH3)CH=CH2、HCOOCH2C(CH3)=CH2、CH3CH2OOCCH=CH2、CH3COOCH2CH=CH2,共9种,故答案为:9;
(5)以乙醇为原料制备有机物X(CH3CH2OOCCH=CHCH3)需要首先合成CH3CH=CHCOOH,根据![]() ,可以由乙醇先氧化生成乙醛,再由2分子乙醛先合成
,可以由乙醇先氧化生成乙醛,再由2分子乙醛先合成![]() ,将醛基氧化成羧基后将羟基消去即可,合成路线为
,将醛基氧化成羧基后将羟基消去即可,合成路线为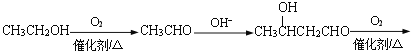
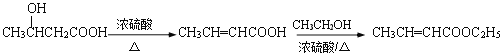 ,故答案为:
,故答案为: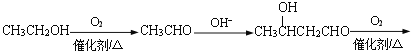
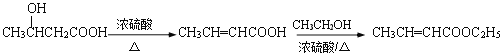 。
。


科目:高中化学 来源: 题型:
【题目】一种新型的“锂-呼吸CO2电池”,结构如图所示,下列说法不正确的是

A. 该装置是化学能转变为电能
B. 利用该技术可减少温室气体CO2的排放
C. 正极的电极反应为:2CO2 + 2e- = C2O42-
D. 每生成10.2g Li2C2O4,有0.2mol Li+从正极迁移至负极
【答案】D
【解析】A、该装置为原电池装置,将化学能转化为电能,故A正确;B、由图可知,CO2转化为C2O42-,可减少温室气体的排放,故B正确;C、CO2→C2O42-,碳元素化合价降低,得电子,则CO2在正极发生反应,电极反应为:2CO2 +2e-=C2O42-,故C正确;D、原电池中,阳离子向正极移动,故D错误。故选D。
【题型】单选题
【结束】
27
【题目】用惰性电极电解足量下列溶液一段时间后,再加入一定量括号内的纯净物,能使溶液恢复到原来的成分和浓度的是
A. AgNO3[AgNO3] B. NaOH[NaOH] C. KCl[H2O] D. CuSO4[CuO]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质的晶体中,化学键类型相同、晶体类型也相同的是( )
A.SO2和SiO2B.CO2和H2O
C.NaCl和HClD.CCl4和NH4Cl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,用0.1mol·L-1HCl溶液滴定20.00mL 0.1mol·L-1BOH溶液所得的滴定曲线如图,下列说法正确的是
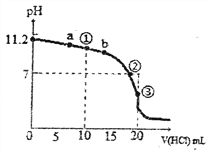
A. BOH为一元弱碱,滴定到点③时,该一元弱碱的电离平衡常数Kb约为10-5.6
B. 滴加盐酸的过程中,当溶液中c(BOH)=c(B+)时,可能出现在b点
C. 滴加盐酸的过程中水的电离程度逐渐增大,在②点时达到最大,后又逐渐减小
D. 点①所示溶液中:c(B+)+c(H+)>c(BOH)+c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有①MgSO4,②Ba(NO3)2,③NaOH,④CuCl2,⑤KCl五种溶液,不加任何其他试剂,可鉴别且鉴别的先后顺序也正确的是( )
A.④③②①⑤B.④⑤③②①C.④③①②⑤D.④②③①⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,下列各组离子在指定溶液中一定能大量共存的是( )
A. 无色透明的溶液中:K+、Cu2+、NO![]() 、Cl-
、Cl-
B. 0.1 mol·L-1CaCl2溶液中:Mg2+、NH![]() 、CO
、CO![]() 、SO
、SO![]()
C. pH=12的溶液:Na+、K+、SiO![]() 、Cl-
、Cl-
D. 使甲基橙变红的溶液中:Na+、Fe2+、NO![]() 、Cl-
、Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电化学在日常生活中用途广泛,下图是镁—次氯酸钠燃料电池,电池总反应为:Mg+ClO-+H2O===Cl-+Mg(OH)2↓,下列说法不正确的是( )
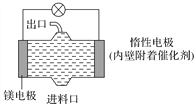
A. 惰性电极上发生氧化反应
B. 镁电极是该电池的负极
C. 正极反应式为ClO-+H2O+2e-===Cl-+2OH-
D. 进料口加入NaClO溶液,出口流出的为NaCl溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下进行反应:COCl2(g)![]() Cl2(g)+CO(g)。向2.0 L恒容密闭容器中充入1.0 mol COCl2(g),经过一段时间后达到平衡。反应过程中测得的有关数据见下表:
Cl2(g)+CO(g)。向2.0 L恒容密闭容器中充入1.0 mol COCl2(g),经过一段时间后达到平衡。反应过程中测得的有关数据见下表:
t/s | 0 | 2 | 4 | 6 | 8 |
n(Cl2)/mol | 0 | 0.30 | 0.39 | 0.40 | 0.40 |
下列说法正确的是( )
A. 保持其他条件不变,升高温度,平衡时c(Cl2)=0.22 mol·L-1,则反应的ΔH<0
B. 若在2 L恒容绝热(与外界没有热量交换)密闭容器进行该反应,化学平衡常数不变
C. 保持其他条件不变,起始向容器中充入1.2 mol COCl2、0.60 mol Cl2和0.60 mol CO,反应达到平衡前的速率:v(正)>v(逆)
D. 保持其他条件不变,起始向容器中充入1.0 mol Cl2和0.8 mol CO,达到平衡时,Cl2的转化率小于60%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家对一碳化学进行了广泛深人的研究并取得了一些重要成果。
(1)已知:CO(g)+2H2(g) ![]() CH3OH(g) △H1=-90.1kJ/mol;
CH3OH(g) △H1=-90.1kJ/mol;
3CH3OH(g)![]() CH3CH=CH2(g)+3H2O(g) △H2=-31.0kJ/mol
CH3CH=CH2(g)+3H2O(g) △H2=-31.0kJ/mol
CO与H2合成CH3CH=CH2的热化学方程式为________。
(2)现向三个体积均为2L的恒容密闭容器I、II、Ⅲ中,均分别充入1molCO 和2mo1H2,发生反应:CO(g)+2H2(g)![]() CH3OH(g) △H1=-90.1kJ/mol。三个容器的反应温度分别为Tl、T2、T3且恒定不变。当反应均进行到5min时H2的体积分数如图1所示,其中只有一个容器中的反应已经达到平衡状态。
CH3OH(g) △H1=-90.1kJ/mol。三个容器的反应温度分别为Tl、T2、T3且恒定不变。当反应均进行到5min时H2的体积分数如图1所示,其中只有一个容器中的反应已经达到平衡状态。

①5min时三个容器中的反应达到化学平衡状态的是容器_______(填序号)。
②0-5 min内容器I中用CH3OH表示的化学反应速率v(CH3OH)=_______。
③当三个容器中的反应均达到平衡状态时,CO的转化率最高的是容器___________。(填序号,下同);平衡常数最小的是容器_____________。
(3)CO常用于工业冶炼金属,在不同温度下用CO 还原四种金属氧化物,达到平衡后气体中![]() 与温度(T)的关系如图2所示。下列说法正确的是_____(填字母)。
与温度(T)的关系如图2所示。下列说法正确的是_____(填字母)。

a.工业上可以通过增高反应装置来延长矿石和CO接触面积,减少尾气中CO的含量
b.CO用于工业冶炼金属铬(Cr)时,还原效率不高
c.工业冶炼金属铜(Cu) 时,600℃下CO的利用率比1000℃下CO的利用率更大
d.CO还原PbO2的反应△H>0
(4)工业废水中含有甲醛,该厂降解甲醛的反应机理如图3所示,则X表示的粒子是_____,总反应的化学方程式为_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com