
【题目】下列各组物质的晶体中,化学键类型相同、晶体类型也相同的是( )
A.SO2和SiO2B.CO2和H2O
C.NaCl和HClD.CCl4和NH4Cl
 期末100分闯关海淀考王系列答案
期末100分闯关海淀考王系列答案 小学能力测试卷系列答案
小学能力测试卷系列答案科目:高中化学 来源: 题型:
【题目】(1)检验葡萄汁含葡萄糖的方法是:向其中加碱调至碱性,再加入新制备的Cu(OH)2,加热,其现象是______________。
(2)有机物E由碳、氢、氧三种元素组成,可由葡萄糖发酵得到,也可从酸牛奶中提取,纯净的E为无色粘稠液体,易溶于水。已知E的分子式为C3H6O3,则:
①实验证实其中含有羟基,羧基,甲基,则E的结构简式为______________。
②写出E与足量Na反应的化学方程式_____________________________________。
③写出E与足量NaHCO3反应的化学方程式_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】十氢萘是具有高储氢密度的氢能载体,经历“十氢萘(C10H18)→四氢萘(C10H12)→萘(C10H8)”的脱氢过程释放氢气。已知:
Ⅰ C10H18(l)==C10H12(l)+3H2(g) ΔH1 Ⅱ C10H12(l)==C10H8(l)+2H2(g) ΔH2
假设某温度下, ΔH1>ΔH2>0。在下图中绘制下列“C10H18→C10H12→C10H8”的“能量~反应过程” 示意图正确的是: ( )
A. 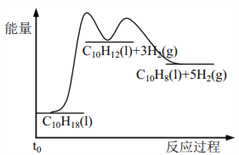 B.
B. 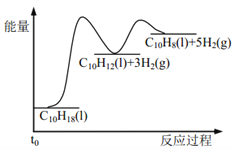
C. 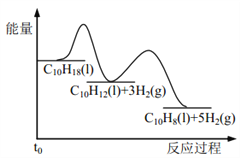 D.
D. 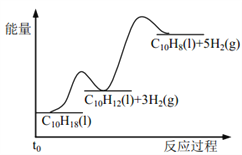
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于离子键、共价键的下列说法中正确的是( )
A.CaCl2中既有离子键又有共价键
B.非极性键只存在于双原子的单质分子(如Cl2)中
C.在共价化合物分子内,一定不存在离子键
D.由多种元素组成的多原子分子里,一定只存在极性键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将一定浓度的HA和HB分别与0.10 mol·L-1的NaOH溶液等体积混合,记录数据如下表,下列说法中正确的是
混合后的溶液 | 加入的酸 | 酸的浓度/(mol·L-1) | 混合后溶液的pH |
① | HA | 0.10 | 8.7 |
② | HB | 0.12 | 2 |
A. HA是强酸,HB是弱酸
B. 溶液①中离子浓度的关系:c(A-)>c(Na+)>c(OH-)>c(H+)
C. 溶液②中离子浓度的关系:c(Na+)+c(H+)+c(B-)=0.12 mol·L-1
D. 升高温度,溶液②中![]() 增大
增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】光合作用得地球碳、氧循环的更要媒介。下图是利用模拟光合作用过程,将CO2和H2O转化为糖类同时释放O2的装置。下列说法正确的是
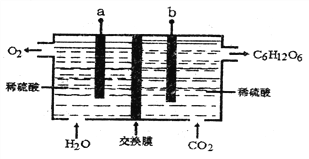
A. 该装置为原电池,其中a是原电池的正极
B. 该交换膜为阳离子交换膜,H+交换膜由左向右移动
C. 不考虑其它能量损耗,当外电路通过1mole-时生成15g葡萄糖
D. b极发生的电极反应:6CO2+24e-+18H2O=C6H12O6+24OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】功能高分子材料M( ![]() )具有化学反应活性、光敏性、生物相容性等特点。下面是合成M的流程:
)具有化学反应活性、光敏性、生物相容性等特点。下面是合成M的流程:
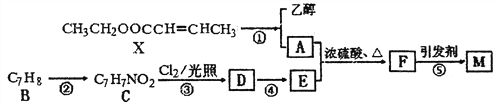
(1)物质C的名称为____________;物质M的分子式为______________。
(2)写出反应①的化学方程式______________________________________。
(3)反应④的反应条件是__________反应①至⑤,5个反应中属于取代反应的有_____个。
(4)有机物N的分子式为C5H8O2,该有机物存在多种同分异构体,其中同时符合以下条件的有_____种。
①与有机物X互为同系物;②碳碳双键上连有羟基不稳定,不考虑此类醇形成酯的结构。
(5)已知:![]()
设计一条以乙醇为原料制备有机物X的合成路线(无机试剂任选)。____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜及其化合物在工农业生产及日常生活中应用非常广泛。
(1) 由辉铜矿制取铜的反应过程为:
2Cu2S(s)+3O2(g)===2Cu2O(s)+2SO2(g) ΔH=-768.2 kJ·mol-1,
2Cu2O(s)+Cu2S(s)===6Cu(s)+SO2(g) ΔH=+116.0 kJ·mol-1,
①热化学方程式:Cu2S(s)+O2(g)===2Cu(s)+SO2(g) ΔH= ________kJ·mol-1。
②获得的粗铜需电解精炼,精炼时粗铜作________极。
(2) 氢化亚铜是一种红色固体,可由下列反应制备:4CuSO4+3H3PO2+6H2O===4CuH↓+4H2SO4+3H3PO4。
①该反应还原剂是____________(写化学式)。
②该反应每转移3 mol电子,生成CuH的物质的量为________。
(3) 氯化铜溶液中铜各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与c(Cl-)的关系如图所示。
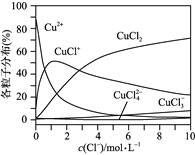
①当c(Cl-)=9 mol·L-1时,溶液中主要的3种含铜物种的浓度大小关系为__________________________。
②在c(Cl-)=1 mol·L-1的氯化铜溶液中,滴入AgNO3溶液,含铜物种间转化的离子方程式为___________________________,___________________________(任写两个)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com