
【题目】下列事实不能用勒夏特利原理来解释的是
A. 用排饱和食盐水的方法收集氯气
B. 增大压强,有利于SO2和O2反应生成SO3
C. 在Fe3++3SCN-![]() Fe(SCN)3反应达平衡时,增加KSCN的浓度,体系颜色变深
Fe(SCN)3反应达平衡时,增加KSCN的浓度,体系颜色变深
D. 合成氨工业选择高温(合成氨反应为放热反应)
【答案】D
【解析】
勒夏特列原理为:如果改变影响平衡的条件之一,平衡将向着能够减弱这种改变的方向移动。使用勒夏特列原理时,该反应必须是可逆反应,否则勒夏特列原理不适用。
A.实验室可用排饱和食盐水的方法收集氯气,氯气和水的反应是可逆反应,饱和氯化钠溶液中氯离子浓度大,化学平衡逆向进行,减小氯气溶解度,能用勒沙特列原理解释,故A不选;
B.SO2和O2反应生成SO3,是气体体积缩小的反应,增大压强,有利于平衡正向移动,故B不选;
C.增加KSCN的浓度,有利于平衡向正反应方向移动,Fe(SCN)3浓度增大,体系颜色变深,故C不选。
D.合成NH3的反应为放热反应,升高温度平衡向逆反应方向移动,但升高温度为加快反应速率,与平衡移动无关,故D选;
答案选D。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】工业制玻璃主要原料有石英、纯碱和石灰石.在玻璃窑中发生主要反应的化学方程式为:①Na2CO3+SiO2![]() Na2SiO3+CO2↑;②CaCO3+SiO2
Na2SiO3+CO2↑;②CaCO3+SiO2![]() CaSiO3+CO2↑。
CaSiO3+CO2↑。
(1)反应①中,被破坏的微粒间的作用力有__________(选填编号)。
a. 范德华力 b. 离子键 c. 共价键
(2)上述两个反应的反应物和生成物中,涉及到的不同类型的晶体有____种(填数字),其中熔沸点最低的化合物的电子式为___;该化合物熔沸点低于CS2的原因是____。
(3)纯碱中的金属阳离子的半径比铝离子半径______(填“大”或“小”);石灰石中的金属阳离子的电子所占据的电子层中,能量最高的是___层(填“电子层符号”)。
(4)已知10 g碳酸钙完全分解,共吸收17.56 KJ的热量,写出该反应的热化学方程式:_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列溶液中各离子浓度关系正确的是
A. pH=2的醋酸溶液与pH=12的氢氧化钠溶液等体积混合:c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
B. 浓度为0.1 mol·L-1的碳酸氢钠溶液:c(Na+)+ c(H+)=c(HCO3-)+c(OH-)
C. 浓度为0.1 mol·L-1的(NH4)2CO3溶液:c(NH4+)=2c(CO32-)+2c(HCO3-)+2c(H2CO3)
D. 浓度均为0.1 mol·L-1的醋酸溶液与NaOH溶液混合后:c(OH-)=c(H+)+c(CH3COOH)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】相同温度下,体积相同的两个容器中,充入等质量CO2和CO气体,下列判断正确的是( )
A.CO2和CO对容器产生的压强之比是7∶11
B.CO2和CO的密度之比是11∶7
C.CO2和CO的分子数相等
D.CO2和CO的氧原子个数比是22∶7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中正确的是( )
A. 液溴易挥发,在存放液溴的试剂瓶中应加水封
B. 能使润湿的淀粉KI试纸变成蓝色的物质一定是Cl2
C. 某溶液加入CCl4,CCl4层显紫色,证明原溶液中存在I-
D. 某溶液加入BaCl2溶液,产生不溶于稀硝酸的白色沉淀,该溶液一定含有Ag+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三种常见单萜类化合物的结构如下图所示。下列说法正确的是( )
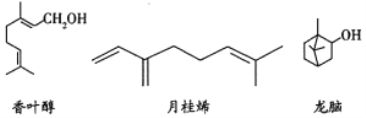
A. 香叶醇和龙脑互为同分异构体,分子式均为![]()
B. 可用金属钠鉴别香叶醇和月桂烯
C. 龙脑分子中所有碳原子在同一个平面上
D. 1mol月桂烯最多能与![]() 发生加成反应
发生加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含 H2 和 Cl2 的混合气体共 amol,经光照后,所得气体恰好使 bmol NaOH 完全转化为盐。已知:在该温度下,Cl2+NaOH→NaClO3+NaCl+H2O(未配平),则 a、b 关系不正确的是( )
A.b=aB.b≥2aC.a<b<2aD.0<b<a
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物H是合成某种药物的中间体,一种合成路线如下:

回答下列问题:
(1)有机物B的化学名称为______。
(2)反应②的反应类型为______。
(3)反应④所需试剂、条件分别为______。
(4)写出反应③的化学方程式______。
(5)1molE与1molH2完全加成生成1molW,W有多种同分异构体,其中属于α-氨基酸、分子中含两个羧基、且苯环上有两个取代基的W的可能结构共有______种(不考虑立体异构),其中核磁共振氢谱为五组峰,峰面积比为3:2:2:2:2的结构简式为______。
(6)设计以甲苯和(CH3CO)2O为原料制备 的合成路线______(无机试剂任选)。
的合成路线______(无机试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(加试题)烟气(主要污染物SO2、NO、NO2)的大量排放造成严重的大气污染,国内较新研究成果是采用以尿素为还原剂的脱硫脱硝一体化技术。
(1)脱硫总反应:SO2(g)+CO(NH2)2(aq)+2H2O(l)+1/2O2(g)=(NH2)SO4(aq)+CO2(g),已知该反应能自发进行,则条件是____(填“高温”、“低温”或“任何温度”)。
(2)电解稀硫酸制备O3(原理如图),则产生O3的电极反应式为______。


(3)室温下,往恒容的反应器中加入固定物质的量的SO2和NO,通入O3充分混合。反应相同时间后,各组分的物质的量随n(O3)∶n(NO)的变化见上图。
① n(NO2)随n(O3)∶n(NO)的变化先增加后减少,原因是____。
② 臭氧量对反应SO2(g)+O3(g)=SO3(g)+O2(g)的影响不大,试用过渡态理论解释可能原因__。
(4)通过控制变量法研究脱除效率的影响因素得到数据如下图所示,下列说法正确的是____。
A. 烟气在尿素溶液中的反应:v(脱硫)<v(脱硝)
B. 尿素溶液pH的变化对脱硝效率的影响大于对脱硫效率的影响
C. 强酸性条件下不利于尿素对氮氧化物的脱除
D. pH=7的尿素溶液脱硫效果最佳


(5)尿素的制备:2NH3(g)+CO2(g)![]() CO(NH2)2(s)+H2O(g) ΔH<0。一定条件下,往10 L恒容密闭容器中充入2 mol NH3和1 mol CO2。
CO(NH2)2(s)+H2O(g) ΔH<0。一定条件下,往10 L恒容密闭容器中充入2 mol NH3和1 mol CO2。
① 该反应10 min 后达到平衡,测得容器中气体密度为4.8 g·L-1,平衡常数K=__。

② 上图是该条件下,系统中尿素的物质的量随反应时间的变化趋势,当反应时间达到3min 时,迅速将体系升温,请在图中画出3~10 min 内容器中尿素的物质的量的变化趋势曲线__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com