
����Ŀ�������������ڸ������������ӹ����жϼ���Ӧ�����ӷ���ʽ����ȷ���ǣ� ��
ѡ�� | ���� | ������ | ���ӹ����жϼ���Ӧ�����ӷ���ʽ |
A | �μӰ�ˮ | Na+��Al3+��Cl-��NO3- | ���ܴ������棬Al3++3OH-=Al(OH)3�� |
B | AG=lg[ | NH4+��Fe2+��I����NO3- | һ���ܴ������� |
C | pH=1����Һ | Fe2+��Al3+�� SO42-��MnO4- | ���ܴ������棬5Fe2++MnO4-+8H+=Mn2++5Fe3++4H2O |
D | ͨ������SO2���� | K+��Na+��ClO-��SO42- | ���ܴ������棬2ClO-+SO2+H2O=2HClO+SO32- |
A.AB.BC.CD.D
 ������������Ӧ����ϵ�д�
������������Ӧ����ϵ�д� ͬ����չ�Ķ�ϵ�д�
ͬ����չ�Ķ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ�������£���һ���������ܱ������г���2 mol SO2��1 mol O2���������з�Ӧ��2SO2(g)+O2(g)![]() 2SO3(g)�ﵽƽ���ı�����������SO3����ƽ��Ũ�����ı����ǣ� ��
2SO3(g)�ﵽƽ���ı�����������SO3����ƽ��Ũ�����ı����ǣ� ��
A.�����¶Ⱥ�����������䣬����2 mol SO3(g)
B.�����¶Ⱥ�������ѹǿ���䣬����2 mol SO2(g)
C.�����¶Ⱥ�������ѹǿ���䣬����1 mol O2(g)
D.�����¶Ⱥ�����������䣬����1 mol N2 (g)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ƻ����Ľṹ��ʽΪHOOC![]() CH2��COOH������˵����ȷ����
CH2��COOH������˵����ȷ����
A. ƻ�������ܷ���������Ӧ�Ĺ�������2��
B. 1molƻ�������3mol NaOH�����кͷ�Ӧ
C. 1molƻ��������������Na��Ӧ��������1mol H2
D. HOOC��CH2��CH(OH)��COOH��ƻ���ụΪͬ���칹��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й���![]() ��˵����ȷ����
��˵����ȷ����
A. ����ԭ�ӿ��ܶ���ͬһƽ���� B. ���ֻ������9��̼ԭ����ͬһƽ��
C. ��7��̼ԭ�ӿ�����ͬһֱ�� D. ֻ������5��̼ԭ����ͬһֱ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������CH4��C2H4��C2H6�����л������
��1��������������������ȫȼ��ʱ��ȥO2����������__________��
��2��ͬ״����ͬ�������������������ȫȼ��ʱ��ȥO2����������__________��
��3����������������������ȼ��ʱ�����ɶ�����̼������__________������ˮ������__________��
��4����120�桢1.01��105Paʱ����������̬����������������ϵ�ȼ����ͬ�����²�÷�Ӧǰ���������û�з����仯��������������__________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ϊ̽�����������ķֽ�������������װ����ͼ��ʾ��װ��a�У���K1��K2������ͨ��N2�����ȡ�ʵ���Ӧ���в�������Ϊ��ɫ��ĩ������˵������ȷ����( )
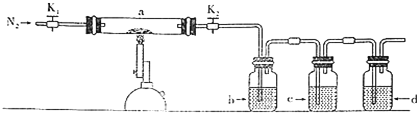
A.װ��d֮����Ҫ����β������װ��
B.װ��b�е��Լ�ΪBa(NO3)2��Һ����Ӧ���а�ɫ��������
C.װ��c�е��Լ�Ϊ����KMnO4��Һ�������dz�ȥ��������е�SO2
D.�ֽ�������������SO3��SO2��Ӧ���ȼ���SO3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������3���Ȼ�ѧ����ʽ��
H2(g)+![]() O2(g)=H2O(g)����H1= -a kJ��mol-1��
O2(g)=H2O(g)����H1= -a kJ��mol-1��
H2(g)+![]() O2(g)=H2O(l)����H2= -b kJ��mol-1��
O2(g)=H2O(l)����H2= -b kJ��mol-1��
2H2(g)+O2(g)=2H2O(l)����H3= -c kJ��mol-1��
�����±����е�ԭ�����Ƶ���������۵���(����)
ѡ�� | ԭ�� | ���� |
A | H2��ȼ���Ƿ��ȷ�Ӧ | a��b��c�������� |
B | �ٺ͢������ʵĻ�ѧ����������ͬ | a=b |
C | �ٺ͢���H2O��״̬��ͬ����ѧ��������ͬ | a��c�������κι�ϵ |
D | �۵Ļ�ѧ�������Ǣڵ�2�� | ��H2����H3 |
A.AB.BC.CD.D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij����С���о���������Al2O3�ĺ������������ϵ�֪�����������Ҫ�ɷ���Al2O3��������Fe2O3��SiO2�ȡ�������������ȡAl2O3�Ĺ������£�

��1����ȡǰ����������������Ŀ����__________��
��2������B����Ҫ��;��________________��д��һ�����ɣ���
��3�������������������м��������ռ���Һ����ַ�Ӧ��������Ӧ�����ӷ���ʽ�У� _____________������дһ������
��4���������м�����������Ŀ����____________________��ʵ��������200mL 8mol/L��������Ҫ�IJ���������__________________��
��5���ܷ�ѵ������еİ�ˮ������������__________������___________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪�ǽ���������S���ǵ���ɫ�����ĩ��������ˮ��Ϊ����֤��Ԫ�صķǽ����Ա���Ԫ�صķǽ�����ǿ��ij��ѧʵ��С�����������ʵ�飬��ش��������⣺

(1)װ��A�ķ�Һ©����ʢװ���Լ���______����ƿ�м�����Լ���______��
(2)�������߿��ڵ�ʵ��װ��ͼ____________����ע�������Լ���˵��װ�õ�����_____________��
(3)װ��B��ʢ�ŵ��Լ���_____��ѡ�����������Լ��Ĵ��룩��ʵ������Ϊ________����ѧ��Ӧ����ʽ��________________��
A��Na2S��Һ B��Na2SO3��Һ C��Na2SO4��Һ
(4)��ԭ�ӽṹ�ĽǶȼ�Ҫ������Ԫ�صķǽ����Ա���Ԫ�صķǽ�����ǿ��ԭ��_________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com