
【题目】下列化合物中同类别同分异构体数目最多的是(不考虑立体异构)( )
A.二甲苯
B.丁醇
C.一氯丁烯
D.二氯丙烷
科目:高中化学 来源: 题型:
【题目】下列各组物质熔化或气化时,所克服的微粒间的作用力属同种类型的是
A. SiO2和CaO的熔化 B. 氧化钠和铁的熔化
C. 碘和干冰的气化 D. 晶体硅和晶体硫的熔化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在某温度下,0.01 mol·L-1NaOH溶液和0.01 mol·L-1的盐酸相比,下列说法正确的是
A. 由水电离出的c(H+)相等
B. 由水电离出的c(H+)都是1.0×10-12mol·L-1
C. 由水电离出的c(OH-)都是0.01 mol·L-1
D. 两者都促进了水的电离
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】欲除去甲烷中的乙烯并得到纯净的甲烷,可依次将其通过洗气瓶
A. 澄清石灰水,浓H2SO4B. 溴水,浓H2SO4
C. 酸性高锰酸钾溶液,浓H2SO4D. 浓H2SO4 ,酸性高锰酸钾溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A~H八种短周期主族元素在周期表中的相对位置如下图所示,已知C元素形成的单质有“国防金属”的美誉,E的最高价氧化物对应的水化物能与E的最简单氢化物反应生成离子化合物。

(1)写出B、G对应的元素符号______________ 。
(2)D元素在周期表中的位置为______________。
(3)B、E、F的简单离子半径由大到小的顺序为______________(写离子符号)。
(4)上述元素所形成的气态单质中能用于饮用水消毒的是______________(写化学式)。
(5)B的单质在F的单质中燃烧的火焰颜色为______________,所形成化合物的电子式为______________。
(6)C元素的单质可以在D和F组成的一种气态化合物中燃烧,写出该反应的化学方程式________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家发现C60 后,近年又合成了许多球形分子(富勒烯),如C50 、C70 、C120 、C540 等,它们互称为 ( )
A. 同系物 B. 同分异构体 C. 同素异形体 D. 同位素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酸钠是一种工业盐,外观与食盐非常相似,毒性较强。
Ⅰ.经查:①Ksp(AgNO2)=2×10-8,Ksp(AgCl)=1.8×10-10;②Ka(HNO2)=5.1×10-4。请设计最简单的方法鉴别NaNO2和NaCl两种固体______________________
Ⅱ. 某小组同学用如下装置(略去夹持仪器)制备亚硝酸钠
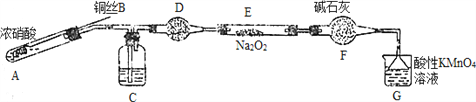
已知:①2NO+Na2O2=2NaNO2; ②酸性条件下,NO和NO2都能与MnO4-反应生成NO3-和Mn2+。
(1)使用铜丝的优点是________________________。
(2)装置A中发生反应的化学方程式为_____________________________。
装置C中盛放的药品是_________;(填字母代号)
A.浓硫酸 B.NaOH溶液 C.水 D.四氯化碳
(3)该小组称取5.000g制取的样品溶于水配成250ml溶液,取25.00ml溶液于锥形瓶中,
用0.1000mol·L-1酸性KMnO4溶液进行滴定,实验所得数据如下表所示:
滴定次数 | 1 | 2 | 3 | 4 |
消耗KMnO4溶液体积/mL | 20.90 | 20.12 | 20.00 | 19.88 |
①第一次实验数据出现异常,造成这种异常的原因可能是_________(填字母代号)。
a.锥形瓶洗净后未干燥
b.酸式滴定管用蒸馏水洗净后未用标准液润洗
c.滴定终点时仰视读数
②酸性KMnO4溶液滴定亚硝酸钠溶液的离子方程式为___________________。
③该样品中亚硝酸钠的质量分数为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.根据下列叙述写出相应的热化学方程式:
(1)已知16 g固体硫完全燃烧时放出148.4 kJ的热量,该反应的热化学方程式是__________________________。
(2)下图是198 K时N2与H2反应过程中能量变化的曲线图。
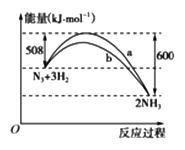
该反应的热化学方程式为:_____________________。
(3)甲硅烷(SiH4)是一种无色气体,遇到空气能发生爆炸性自燃,生成SiO2和液态水。已知室温下1 g甲硅烷自燃放出热量44.6 kJ,其热化学方程式是___________________。
II.
(1)事实证明,能设计成原电池的反应通常是放热反应,下列化学反应在理论上可以设计成原电池的是_____________________。
A.C(s)+H2O(g)=CO(g)+H2(g) △H>0
B.NaOH(aq)+HC1(aq)=NaC1(aq)+H2O(1) △H<0
C.2H2(g)+O2(g)=2H2O(1) △H<0
(2)以KOH溶液为电解质溶液,依据所选反应设计一个原电池,其负极反应为__________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com