
【题目】I.根据下列叙述写出相应的热化学方程式:
(1)已知16 g固体硫完全燃烧时放出148.4 kJ的热量,该反应的热化学方程式是__________________________。
(2)下图是198 K时N2与H2反应过程中能量变化的曲线图。
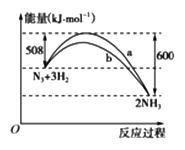
该反应的热化学方程式为:_____________________。
(3)甲硅烷(SiH4)是一种无色气体,遇到空气能发生爆炸性自燃,生成SiO2和液态水。已知室温下1 g甲硅烷自燃放出热量44.6 kJ,其热化学方程式是___________________。
II.
(1)事实证明,能设计成原电池的反应通常是放热反应,下列化学反应在理论上可以设计成原电池的是_____________________。
A.C(s)+H2O(g)=CO(g)+H2(g) △H>0
B.NaOH(aq)+HC1(aq)=NaC1(aq)+H2O(1) △H<0
C.2H2(g)+O2(g)=2H2O(1) △H<0
(2)以KOH溶液为电解质溶液,依据所选反应设计一个原电池,其负极反应为__________________________。
【答案】 S(s)+O2(g)===SO2(g) ΔH=-296.8 kJ·mol-1 N2(g)+3H2(g)===2NH3(g) ΔH=-92 kJ·mol-1 SiH4(g)+2O2(g)===SiO2(s)+2H2O(l) ΔH=-1427.2 kJ/mol C H2+2OH--2e=2H2O
【解析】I.(1)16g固体硫完全燃烧时放出148.4kJ的热量,即1molS完全燃烧时放出放出296.8kj热量,则热化学方程式为:S(s)+O2(g)=SO2(g);△H=-296.8kJ/mol;
(2)该反应放出的能量大于吸收的能量,所以放热,△H=放出的能量-吸收的能量=600kJ/mol-508kJ/mol=92kJ/mol,该反应的热化学方程式为:N2(s)+3H2(g)=2NH3(g) △H=-92kJ/mol;
(3)n(SiH4)=![]() =
=![]() mol,则1molSiH4燃烧放出的热量为:44.6kJ×32=1427.2kJ,反应的化学方程式为:SiH4+O2=SiO2+H2O,则热化学方程式为:SiH4(g)+O2(g)=SiO2(g)+2H2O;△H=-1427.2kJ/mol;
mol,则1molSiH4燃烧放出的热量为:44.6kJ×32=1427.2kJ,反应的化学方程式为:SiH4+O2=SiO2+H2O,则热化学方程式为:SiH4(g)+O2(g)=SiO2(g)+2H2O;△H=-1427.2kJ/mol;
II.(1)A.C(s)+CO2(g)=2CO(g)△H>0,为氧化还原反应,但为吸热反应,不能设计为原电池,故A错误;B.NaOH(aq)+HC1(aq)=NaC1(aq)+H2O(1)△H<0,不属于氧化还原反应,不能设计为原电池,故B错误;C.2H2(g)+O2(g)═2H2O(l)△H<0,为氧化还原反应,为放热反应,能设计为原电池,故C正确;故选C;
(2)氢氧燃烧电池,负极上氢气发生氧化反应,在碱性条件下生成水,发生的电极反应为H2+2OH--2e=2H2O。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】下列关于硫的叙述中,正确的是 ( )
A.硫的非金属性较强,故只能以化合态存在于自然界中
B.能与Cu、Fe、O 2 等物质反应,S作氧化剂
C.硫燃烧得SO 3 ,可以制得硫酸
D.S与Cu反应生成Cu 2 S,而不能生成CuS
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢氧燃料电池已用于航天飞机,它是以铂作电极,以KOH溶液作电解质,下列叙述中不正确的是
A.H2在负极发生氧化反应
B.燃料电池的化学能可以全部转化为电能
C.产物为无污染的水,属于环境友好电池
D.供电时的总反应为:2H2 + O2 = 2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g)在5L密闭容器中进行,半分钟后NO的物质的量增加了0.3mol,则此反应的平均速率v为
4NO(g)+6H2O(g)在5L密闭容器中进行,半分钟后NO的物质的量增加了0.3mol,则此反应的平均速率v为
A.v(O2)=0.01mol/(L·s) B.v(NO)=0.08mol/(L·s)
C.v(H2O)=0.003mol/(L·s) D.v(NH3)=0.001mol/(L·s)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 铜的金属活泼性比铁的弱,可在海轮外壳上镶入若干铜块以减缓其腐蚀
B. 向0.1 mol·L-1 CH3COONa溶液中加入少量水,溶液中![]() 减小
减小
C. 一定温度下,增大反应2BaO2(s)![]() 2BaO(s)+O2(g)容器的体积,平衡不移动
2BaO(s)+O2(g)容器的体积,平衡不移动
D. 反应TiO2(s) + 2Cl2(g)=TiCl4(g) + O2(g) ΔH>0能自发进行,其原因是ΔS>0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于S、SO2、H2SO4的叙述中,正确的是( )
A.硫是一种易溶于水的黄色晶体
B.SO2溶于水生成H2SO4
C.用氢氧化钠溶液处理含有SO2的尾气
D.浓H2SO4不稳定,光照易分解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把0.6molX气体和0.4molY气体混合于2L容器中,使它们发生如下反应:3X(气)+Y(气)Z(气)+2W(气) 5min时达到平衡,且生成0.2molW 求
(1)5min内用W、Y表示的反应速率_______________
(2)平衡时,Y的转化率_____________.(Y的转化率=![]()
![]()
![]() )
)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com