
【题目】炼油厂烷基化反应产生的废液中含硫酸91%、难挥发有机物7%。实验室以软锰矿(主要含MnO2,还含少量Fe、Al等元素)处理废液并制取MnSO4·H2O晶体,其实验流程如图:
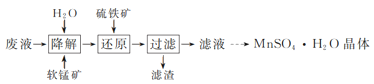
(1)研究温度对“降解”过程中有机物去除率的影响,实验在如图1所示的装置中进行。
①在不同温度下反应相同时间,发现温度从60℃升高到95℃时,有机物去除率从29%增大到58%,其可能的原因是:MnO2的氧化能力随温度升高而增强;__。
②废液因含有机物而呈现黑红色。有机物降解速率慢,难以观察气泡产生速率。降解一段时间,判断有机物浓度基本不变的依据是:三颈烧瓶内__。烧杯中盛放的试剂可以是__。
(2)降解一段时间后,加入硫铁矿(主要成分FeS2)将剩余MnO2还原,所得溶液中的主要离子有Fe3+、Mn2+、SO42-等,其离子方程式为__。
(3)滤液若用足量高纯度MnO2再次氧化降解,改变条件,有机物去除率可达66%。反应后过滤,所得滤渣经洗涤后,在本实验流程中可用于__。
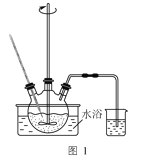
(4)MnSO4·H2O的溶解度曲线如图2所示。设计以过滤所得滤液为原料,进一步除去有机物等杂质并制取MnSO4·H2O晶体的实验方案:__,趁热过滤,用热的硫酸锰溶液洗涤,150℃烘干。[已知pH=5时Fe(OH)3和Al(OH)3沉淀完全;MnSO4·H2O分解温度为200℃。实验中必须使用的试剂:石灰石粉末、活性炭]
【答案】温度升高,反应速率加快 液体颜色不再变浅 NaOH溶液或石灰乳 2FeS2+15MnO2+28H+=2Fe3++15Mn2++4SO42-+14H2O 投入到降解阶段,作为氧化剂使用 在搅拌下向滤液中分批加入石灰石粉末,调节pH略大于5,过滤。向滤液中加入足量活性炭,充分吸附后过滤,将滤液在加压条件下,控制在180℃左右结晶
【解析】
由流程图可知,废液中含硫酸91%、难挥发有机物7%,通过加入软锰矿和水,将废液中的有机物降解,加入硫铁矿(主要成分FeS2)将剩余MnO2还原,滤液经过处理,将其他杂质离子除去,最终得到MnSO4H2O晶体。
(1)①升高温度,反应速率加快,在相同时间内有机物反应的更多,去除率增加;
②废液因含有机物而呈现黑红色,有机物越少,颜色越浅,故可通过颜色来判断反应情况;废液中有浓度较高的硫酸,可以与有机物发生氧化还原反应,浓硫酸被还原成SO2,可用碱液来吸收,所以烧杯中可以加入NaOH溶液或石灰乳;
(2)MnO2为氧化剂,FeS2为还原剂,在酸性条件下发生氧化还原反应。根据反应后溶液中有Fe3+、Mn2+、SO42-,可推断出反应方程式为:2FeS2+15MnO2+28H+=2Fe3++15Mn2++4SO42-+14H2O;
(3)由于投入MnO2的是足量的,反应后MnO2会有剩余,可以投入到降解阶段,作为氧化剂使用;
(4)滤液中含有Fe3+、Al3+有机物等杂质,先用石灰石调节溶液的pH至略大于5,使Fe3+、Al3+完全沉淀;有色的有机物杂质可用活性炭进行吸附。根据图2可知,温度越高,MnSO4H2O溶解度越小,但是200℃时MnSO4H2O会分解,所以结晶温度选择图中最高的180℃,常压下,水无法达到180℃,故此处要加压条件下结晶;


科目:高中化学 来源: 题型:
【题目】已知:还原性HSO3->I-,氧化性IO3->I2>SO42-,在含0.3molNaHSO3的溶液中逐滴加入KIO3溶液.加入KIO3和析出I2的物质的量的关系曲线如图所示.下列说法不正确的是( )
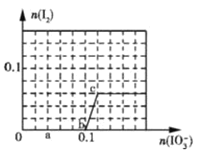
A.0~b间的反应可用如下离子方程式表示:3HSO3-+IO3- ═3SO42-+I-+3H+
B.a点时消耗NaHSO3的物质的量为0.12mol
C.当溶液中的I-为0.04 mol时,加入的KIO3只能是0.04mol
D.b点时的还原产物可能是KI或NaI,b~c间的还原产物是I2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年,大连化物所研究人员在乙酰酮修饰锰氧化物L酸催化胺选择氧化研究方面取得新的进展(如图甲所示),相关文章发表在《自然通讯》上。请回答下列问题:
(1)基态Mn原子的价电子排布图为________________,其中最外层电子的电子云轮廓图的形状为________________。
(2)图甲中涉及的非金属元素(除H外)第一电离能由小到大的顺序是________________(用元素符号表示,下同),电负性由小到大的顺序是________________。
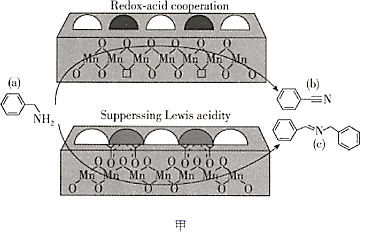
(3)物质a可与水互溶,主要原因是________________。
(4)物质b中碳原子的轨道杂化方式有________________,1 mol物质c中含有σ键的数目为________________。
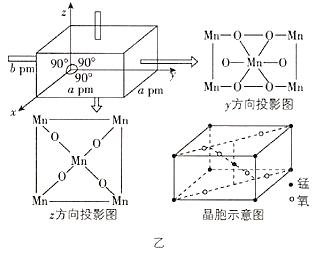
(5)该锰氧化物的晶胞结构如图乙所示,该锰氧化物的化学式为________________,该晶体中Mn的配位数是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学利用下图的实验装置进行铁跟水蒸气反应的实验,并继续研究铁及其化合物的部分性质。
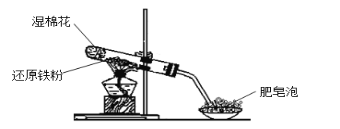
请回答下列问题:
(1)图中湿棉花的作用是____________;硬质试管中发生反应的化学方程式为__________ 。
(2)该同学推测反应后硬质试管中固体物质的成分有两种可能性:ⅰ只有Fe3O4 ,ⅱFe3O4和Fe都有;并设计了如下实验方案验证:
①待硬质试管冷却后,将固体磨碎后,取少许其中的固体物质溶于稀硫酸得溶液B;
②取少量溶液B滴加KSCN溶液,溶液未变红色,则说明硬质试管中固体物质的成分是____。溶液未变红色的主要原因是:______(用离子方程式表示)。
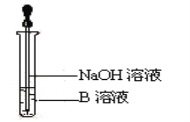
(3)该同学马上另取少量溶液B于试管中,按下图所示的操作,可观察到生成白色沉淀,迅速变成灰绿色,最后变成红褐色的现象,请写出上述白色沉淀变成红褐色的化学方程式:_______。
(4)该同学向②的溶液中加入几滴氯水溶液变成红色,说明Fe2+具有______性。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液中物质的量浓度为1mol·L-1的是( )
A. 将20g NaOH固体溶解在500mL水中
B. 将10g NaOH固体溶解在水中配成250mL溶液
C. 将1L 10 mol·L-1的浓盐酸与9L水混合
D. 将标准状况下22.4L HCl气体溶于1L水中配成溶液(已知HCl极易溶于水,0℃时,1体积水能溶解500体积的氯化氢)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验原理、方法和结论都正确的是( )
A.向FeCl2溶液中滴加氯水,溶液颜色变成棕黄色,可以证明氯水中含有HClO
B.向一定浓度的CuSO4溶液中通入适量H2S气体,出现黑色沉淀,可以证明氢硫酸的酸性比H2SO4强
C.向乙酸乙酯和少量乙酸的混合溶液中加入过量KOH溶液,振荡、静置后分液,可以除去乙酸乙酯中的少量乙酸
D.向苯和少量苯酚的混合溶液中加入适量NaOH溶液,振荡、静置后分液,可以除去苯中的少量苯酚
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室需要0.1mol·L-1NaOH溶液450mL和0.5mol·L-1硫酸溶液500mL。根据这两种溶液的配制情况回答下列问题:
(1)如图所示的仪器中配制溶液肯定不需要的是__________(填序号),配制上述溶液还需用到的玻璃仪器是__________(填仪器名称)。
(2)配制0.1mol·L-1NaOH溶液操作步骤如下:
①把称量好的NaOH`固体放入小烧杯中,加适量蒸馏水溶解;
②把①所得溶液冷却至室温,再小心转入一定容积的容量瓶中;
③继续向容量瓶中加蒸馏水至液面距刻度线1~2cm处,改用胶头滴管小心滴加蒸馏水至溶液凹液面与刻度线相切;
④用少量蒸馏水洗涤烧杯和玻璃棒2~3次,每次洗涤的液体都小心转入容量瓶,并轻轻摇匀;
⑤将容量瓶瓶塞塞紧,充分摇匀。
操作步骤的正确顺序为__________(填序号)。
(3)根据计算用托盘天平称取NaOH的质量为__________g。在实验中其他操作均正确,若容量瓶用蒸馏水洗涤后未干燥,则所得溶液浓度______________0.10mol·L-1(填“大于”“等于”或“小于”,下同)。若还未等溶液冷却就定容了,则所得溶液浓度__________0.10mol·L-1。
(4)根据计算得知,所需质量分数为98%、密度为1.84g·cm-3的浓硫酸的体积为__________mL(计算结果保留一位小数)。如果实验室有10mL、15mL、20mL、50mL的量筒,应选用__________mL的量筒最好。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学校化学学习小组为探究二氧化氮的性质,按下图所示装置进行实验。

(1)装置甲中盛放浓硝酸的仪器A的名称是______,该装置中发生反应的化学方程式为________________________。
(2) 装置丙中的试管内发生反应的离子方程式为:_______________________。
(3)为了探究NO的还原性,可以在装置丁的导气管C中通入一种气体,通入的这种气体的名称是________。
(4)取下装置丙中的试管D,在其中滴加FeSO4溶液,溶液变为________色,为了证明铁元素在该反应中的产物,可以再在溶液中滴加KSCN溶液,溶液变为________色。
(5)硝酸厂常用催化还原方法处理尾气。CH4在催化条件下可以将NO2还原为N2。
已知:CH4(g)+2O2(g)===CO2(g)+2H2O(g)ΔH=-889.6 kJ·mol-1①
N2(g)+2O2(g)===2NO2(g)ΔH=+67.7 kJ·mol-1②
则CH4还原NO2生成水蒸气和氮气的热化学方程式是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为研究沉淀的生成及其转化,某小组进行如图实验。关于该实验的分析不正确的是
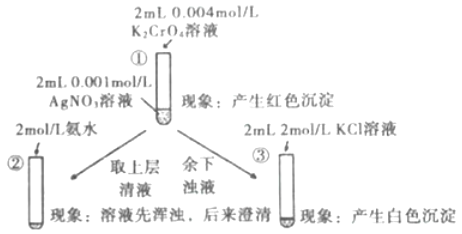
A.①浊液中存在平衡:Ag2CrO4(s)2Ag+(aq)+CrO42-(aq)
B.②中溶液变澄清的原因:AgOH+2NH3·H2O=[Ag(NH3)2]OH+2H2O
C.③中颜色变化说明有AgCl生成
D.该实验可以证明AgCl比Ag2CrO4更难溶
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com