
【题目】已知:还原性HSO3->I-,氧化性IO3->I2>SO42-,在含0.3molNaHSO3的溶液中逐滴加入KIO3溶液.加入KIO3和析出I2的物质的量的关系曲线如图所示.下列说法不正确的是( )
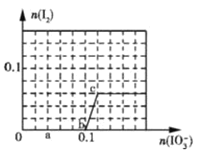
A.0~b间的反应可用如下离子方程式表示:3HSO3-+IO3- ═3SO42-+I-+3H+
B.a点时消耗NaHSO3的物质的量为0.12mol
C.当溶液中的I-为0.04 mol时,加入的KIO3只能是0.04mol
D.b点时的还原产物可能是KI或NaI,b~c间的还原产物是I2
【答案】C
【解析】
还原性HSO3->I-,所以首先是发生以下反应离子方程式:IO3-+3HSO3-═I-+3SO42-+3H+,继续加入KIO3,氧化性IO3->I2,所以IO3-可以结合H+氧化I-生成I2,离子方程式是IO3-+6H++5I-═3H2O+3I2,
A.0~b间没有碘单质生成,说明碘酸根离子和亚硫酸氢根离子发生氧化还原反应生成碘离子,加入碘酸钾的物质的量是0.1mol,亚硫酸氢钠的物质的量是0.3mol,亚硫酸氢根被氧化生成硫酸根离子,根据转移电子守恒知,生成碘离子,所以其离子方程式为:3HSO3-+IO3- ═3SO42-+I-+3H+,选项A正确;
B.a点碘酸钾的物质的量是0.04mol,根据碘酸钾和亚硫酸氢钠的关系式知,消耗NaHSO3的物质的=![]() =0.12mol,选项B正确;
=0.12mol,选项B正确;
C.当溶液中的I-为0.04mol时,有两种情况:
一是只发生反应IO3-+6H++5I-═3H2O+3I2,生成I-为0.04mol,根据碘元素守恒n(KIO3)=n(I-)=0.04mol;
二是HSO3-反应完毕后,还发生IO3-+6H++5I-═3H2O+3I2,剩余I-为0.04mol,3molNaHSO3消耗1molKIO3、生成1molI-,故反应IO3-+6H++5I-═3H2O+3I2中消耗的I-为0.1mol-0.04mol=0.06mol,消耗KIO3的物质的量为0.06mol×![]() =0.012mol,故共加入的KIO3为0.1mol+0.012mol=0.112mol,选项C不正确;
=0.012mol,故共加入的KIO3为0.1mol+0.012mol=0.112mol,选项C不正确;
D.根据图象知,b点碘酸根离子完全反应生成碘离子,所以其还原产物可能是碘化钠或碘化钾,b-c段内,碘离子部分被氧化生成碘单质,所以b~c间的还原产物是I2,选项D正确;
答案选C。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】不同条件下,物质X可转化为Y,也可转化为Z,转化过程中的能量变化如图所示。下列说法正确的是( )
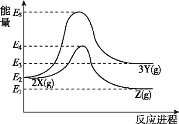
A.由2X→3Y的反应是放热反应
B.X、Y、Z三种物质中最不稳定的是Z
C.反应物总键能大于Z物质的总键能
D.若Y可转化为Z,则相应的反应是放热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组同学欲探究NH3的催化氧化反应,按下图装置进行实验。A、B装置可选用的药品:浓氨水、H2O2溶液、蒸馏水、NaOH固体、MnO2。
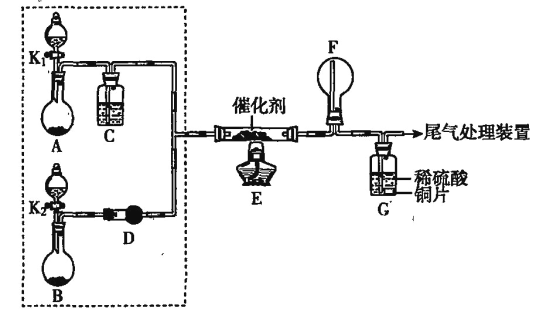
(1)NH3催化氧化的化学方程式是__________。
(2)甲、乙两同学分别按上图装置进行实验。一段时间后,装置G中的溶液都变成蓝色。
①甲观察到装置F中有红棕色气体,生成红棕色气体的化学方程式是__________。
②乙观察到装置F中只有白烟生成,白烟的成分是__________(填化学式)。
③用离子方程式解释装置G中溶液变成蓝色的原因:__________。
(3)为帮助乙实现在装置F中也观察到红棕色气体,可在原实验的基础上进行改进:
①甲认为可调节K1和K2控制A、B装置中的产气量,应__________(填“增加”或“减少”)装置A中的产气量,或__________(填“增加”或“减少”)装置B中的产气量。
②乙认为可在装置E、F间增加置,该装置可以是__________(填字母序号)。
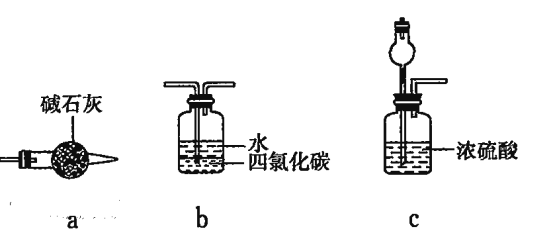
(4)为实现该反应,也可用下图所示的装置替换题.给装置中虚线框部分,
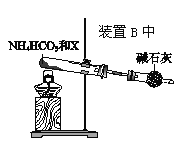
化合物X为__________。NH4HCO3的作用是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以“物质的量”为中心的计算是化学计算的基础,下列与“物质的量”相关的计算正确的是( )
A.a g Cl2中有b个氯原子,则阿伏加德罗常数NA的数值可表示为71b/a
B.5.6 g CO和22.4 L CO2中含有的碳原子数一定相等
C.将20 g NaOH固体溶解在500 mL水中所得溶液的物质的量浓度为1 mol·L-1
D.现有等物质的量的CO和CO2,这两种气体中氧原子的质量之比为1∶2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用下列所给装置难以达到相应实验目的的是( )
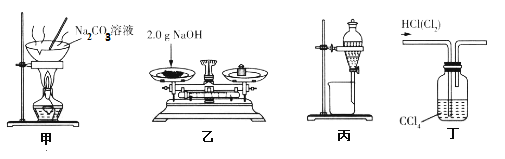
A.装置甲:蒸发结晶,制备纯碱
B.装置乙:称量,配制480 mL0. 10 mol·L-1 NaOH溶液,需称量2.0 g NaOH
C.装置丙:分液,四氯化碳萃取碘水中的I2后,分液获得碘的四氯化碳溶液
D.装置丁:洗气,除去HCl中Cl2杂质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】β—月桂烯的结构如图所示,下列说法正确的是
![]()
A. 与乙烯互为同系物
B. 与其互为同分异构体且苯环上只有一个侧链的共有4种
C. 化学式为C10H16
D. 一分子该物质与一分子溴发生加成最多有3种产物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨气可有效消除NO2的污染,相关反应为8NH3+6NO27N2+12H2O,在1 L恒容密闭容器中,控制不同温度,分别加入0.50 mol NH3和1.2 mol NO2,测得n(NH3)随时间变化的有关实验数据如下表。
温度 n(NH3)/mol 时间/min | 0 | 10 | 20 | 40 | 50 |
T1 | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 |
T2 | 0.50 | 0.30 | 0.20 | … | 0.18 |
下列说法正确的是( )
A.T1温度下,0-20 min内,NO2的降解速率为0.0125 molL-1min-1
B.实验条件为T1<T2,且该反应为放热反应
C.40 min时,表格中T2对应的数据为0.20
D.0~10 min内,T1温度下NH3的降解速率大于T2温度下的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】胡椒酚是植物挥发油中的一种成分(结构如图所示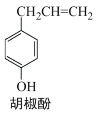 )。关于胡椒酚的下列说法:
)。关于胡椒酚的下列说法:
①该化合物属于芳香烃;
②分子中至少有7个碳原子处于同一平面内;
③它不能与烧碱发生反应;
④1mol该化合物最多可与 3molBr2发生反应。其中正确的是( )
A.①③B.①②④C.②④D.②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】炼油厂烷基化反应产生的废液中含硫酸91%、难挥发有机物7%。实验室以软锰矿(主要含MnO2,还含少量Fe、Al等元素)处理废液并制取MnSO4·H2O晶体,其实验流程如图:
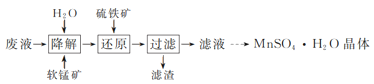
(1)研究温度对“降解”过程中有机物去除率的影响,实验在如图1所示的装置中进行。
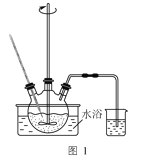
①在不同温度下反应相同时间,发现温度从60℃升高到95℃时,有机物去除率从29%增大到58%,其可能的原因是:MnO2的氧化能力随温度升高而增强;__。
②废液因含有机物而呈现黑红色。有机物降解速率慢,难以观察气泡产生速率。降解一段时间,判断有机物浓度基本不变的依据是:三颈烧瓶内__。烧杯中盛放的试剂可以是__。
(2)降解一段时间后,加入硫铁矿(主要成分FeS2)将剩余MnO2还原,所得溶液中的主要离子有Fe3+、Mn2+、SO42-等,其离子方程式为__。
(3)滤液若用足量高纯度MnO2再次氧化降解,改变条件,有机物去除率可达66%。反应后过滤,所得滤渣经洗涤后,在本实验流程中可用于__。
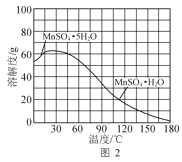
(4)MnSO4·H2O的溶解度曲线如图2所示。设计以过滤所得滤液为原料,进一步除去有机物等杂质并制取MnSO4·H2O晶体的实验方案:__,趁热过滤,用热的硫酸锰溶液洗涤,150℃烘干。[已知pH=5时Fe(OH)3和Al(OH)3沉淀完全;MnSO4·H2O分解温度为200℃。实验中必须使用的试剂:石灰石粉末、活性炭]
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com