
【题目】胡椒酚是植物挥发油中的一种成分(结构如图所示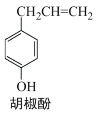 )。关于胡椒酚的下列说法:
)。关于胡椒酚的下列说法:
①该化合物属于芳香烃;
②分子中至少有7个碳原子处于同一平面内;
③它不能与烧碱发生反应;
④1mol该化合物最多可与 3molBr2发生反应。其中正确的是( )
A.①③B.①②④C.②④D.②③④
科目:高中化学 来源: 题型:
【题目】一定条件下,在体积为3L的密闭容器中化学反应CO(g)+2H2(g)![]() CH3OH(g)达到平衡状态。
CH3OH(g)达到平衡状态。
(1)该反应的平衡常数表达式K=__;根据图,升高温度,K值将__(填“增大”、“减小”或“不变”)。
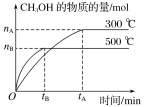
(2)500℃时,从反应开始到化学平衡状态,以H2的浓度变化表示的化学反应速率是__(用nB、tB表示)。
(3)判断该可逆反应达到化学平衡状态的标志是__(填字母,下同)。
a.υ生成(CH3OH)=υ消耗(CO) b.混合气体的密度不再改变
c.混合气体的平均相对分子质量不再改变 d.CO、H2、CH3OH的浓度均不再变化
(4)300℃时,将容器的容积压缩到原来的![]() ,在其他条件不变的情况下,对平衡体系产生的影响是____。
,在其他条件不变的情况下,对平衡体系产生的影响是____。
a.c(H2)减小 b.正反应速率加快,逆反应速率减慢
c.CH3OH的物质的量增加 d.重新平衡时![]() 减小
减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:还原性HSO3->I-,氧化性IO3->I2>SO42-,在含0.3molNaHSO3的溶液中逐滴加入KIO3溶液.加入KIO3和析出I2的物质的量的关系曲线如图所示.下列说法不正确的是( )
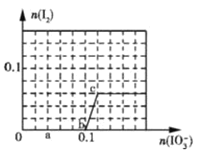
A.0~b间的反应可用如下离子方程式表示:3HSO3-+IO3- ═3SO42-+I-+3H+
B.a点时消耗NaHSO3的物质的量为0.12mol
C.当溶液中的I-为0.04 mol时,加入的KIO3只能是0.04mol
D.b点时的还原产物可能是KI或NaI,b~c间的还原产物是I2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲溶液可能含有K+、Ca2+、NH4+、Cu2+、NO3-、Cl-、SO42-、CO32-八种离子中的若干种![]() 为确定甲溶液的组成,将其分成两等份,进行如下实验:
为确定甲溶液的组成,将其分成两等份,进行如下实验:
①向一份溶液中加入足量的NaOH浓溶液并加热,产生的气体在标准状况下体积为4.48L。
②向另一份溶液中加入0.6 mol/L的BaCl2溶液500mL,恰好可以与溶液中的离子完全反应,过滤得66.3g沉淀及滤液。
③向上述沉淀中加入过量的盐酸,产生的气体通入足量澄清的石灰水中,得到一定量的沉淀X。
④向上述滤液中加入1 mol/L AgNO3溶液650 mL,恰好可完全反应,据此,请回答下列问题![]() 用相应的离子符号表示
用相应的离子符号表示![]() :
:
⑴上述实验③中得到沉淀X的质量为______;生成沉淀X的离子方程式为______.
⑵甲溶液中一定不存在的离子是______;可能存在的离子是______.
⑶甲溶液一定存在的离子中,物质的量最大的离子是______;物质的量最小的离子是______,此物质的量最小的离子其物质的量为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属加工后的废切削液中含有2%~5%的NaNO2,它是一种环境污染物。人们用NH4Cl溶液来处理此废切削液,使亚硝酸钠转化为无毒物质。该反应分两步进行:
第一步:NaNO2+NH4Cl=NaCl+NH4NO2
第二步:NH4NO2![]() N2↑+2H2O
N2↑+2H2O
下列对第二步反应的叙述中正确的是
①NH4NO2仅是氧化剂
②NH4NO2仅是还原剂
③NH4NO2发生了分解反应
④只有氮元素的化合价发生了变化
⑤NH4NO2既是氧化剂又是还原剂
A. ①③ B. ①④
C. ②③④ D. ③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为探究一溴环己烷(![]() )与NaOH的醇溶液共热发生的是水解反应还是消去反应,甲、乙、丙三位同学分别设计如下三个实验方案:
)与NaOH的醇溶液共热发生的是水解反应还是消去反应,甲、乙、丙三位同学分别设计如下三个实验方案:
甲:向反应混合液中滴入稀硝酸中和NaOH,然后再滴入AgNO3溶液,若有浅黄色沉淀生成则可证明发生了消去反应。
乙:向反应混合液中滴入溴水,若溶液颜色很快褪去,则可证明发生了消去反应。
丙:向反应混合液中滴入酸性KMnO4溶液,若溶液颜色变浅,则可证明发生了消去反应。
其中正确的是( )
A. 甲 B. 乙 C. 丙 D. 上述实验方案都不正确
查看答案和解析>>
科目:高中化学 来源: 题型:
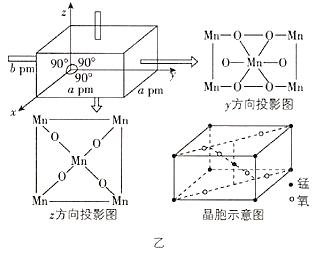
【题目】2019年,大连化物所研究人员在乙酰酮修饰锰氧化物L酸催化胺选择氧化研究方面取得新的进展(如图甲所示),相关文章发表在《自然通讯》上。请回答下列问题:
(1)基态Mn原子的价电子排布图为________________,其中最外层电子的电子云轮廓图的形状为________________。
(2)图甲中涉及的非金属元素(除H外)第一电离能由小到大的顺序是________________(用元素符号表示,下同),电负性由小到大的顺序是________________。
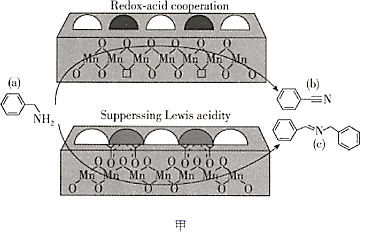
(3)物质a可与水互溶,主要原因是________________。
(4)物质b中碳原子的轨道杂化方式有________________,1 mol物质c中含有σ键的数目为________________。
(5)该锰氧化物的晶胞结构如图乙所示,该锰氧化物的化学式为________________,该晶体中Mn的配位数是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学利用下图的实验装置进行铁跟水蒸气反应的实验,并继续研究铁及其化合物的部分性质。
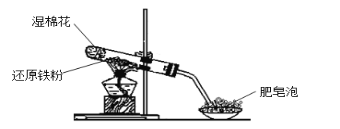
请回答下列问题:
(1)图中湿棉花的作用是____________;硬质试管中发生反应的化学方程式为__________ 。
(2)该同学推测反应后硬质试管中固体物质的成分有两种可能性:ⅰ只有Fe3O4 ,ⅱFe3O4和Fe都有;并设计了如下实验方案验证:
①待硬质试管冷却后,将固体磨碎后,取少许其中的固体物质溶于稀硫酸得溶液B;
②取少量溶液B滴加KSCN溶液,溶液未变红色,则说明硬质试管中固体物质的成分是____。溶液未变红色的主要原因是:______(用离子方程式表示)。
(3)该同学马上另取少量溶液B于试管中,按下图所示的操作,可观察到生成白色沉淀,迅速变成灰绿色,最后变成红褐色的现象,请写出上述白色沉淀变成红褐色的化学方程式:_______。
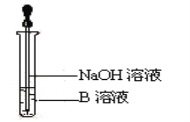
(4)该同学向②的溶液中加入几滴氯水溶液变成红色,说明Fe2+具有______性。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学校化学学习小组为探究二氧化氮的性质,按下图所示装置进行实验。

(1)装置甲中盛放浓硝酸的仪器A的名称是______,该装置中发生反应的化学方程式为________________________。
(2) 装置丙中的试管内发生反应的离子方程式为:_______________________。
(3)为了探究NO的还原性,可以在装置丁的导气管C中通入一种气体,通入的这种气体的名称是________。
(4)取下装置丙中的试管D,在其中滴加FeSO4溶液,溶液变为________色,为了证明铁元素在该反应中的产物,可以再在溶液中滴加KSCN溶液,溶液变为________色。
(5)硝酸厂常用催化还原方法处理尾气。CH4在催化条件下可以将NO2还原为N2。
已知:CH4(g)+2O2(g)===CO2(g)+2H2O(g)ΔH=-889.6 kJ·mol-1①
N2(g)+2O2(g)===2NO2(g)ΔH=+67.7 kJ·mol-1②
则CH4还原NO2生成水蒸气和氮气的热化学方程式是_____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com