
【题目】不同条件下,物质X可转化为Y,也可转化为Z,转化过程中的能量变化如图所示。下列说法正确的是( )
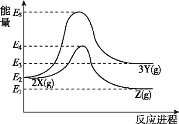
A.由2X→3Y的反应是放热反应
B.X、Y、Z三种物质中最不稳定的是Z
C.反应物总键能大于Z物质的总键能
D.若Y可转化为Z,则相应的反应是放热反应
科目:高中化学 来源: 题型:
【题目】铅蓄电池是典型的可充电电池,电池总反应式为:Pb+PbO2+2H2SO4 ![]() 2PbSO4+2H2O。回答下列问题:
2PbSO4+2H2O。回答下列问题:
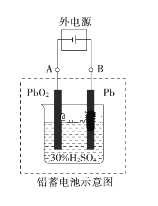
(1)放电时,负极为_______电极,试写出该电极的电极反应式是___________。电解液中H2SO4的浓度将变____________。(填“升高”、 “降低” 或“不变”)
(2)电池放电时,当外电路通过0.1 mol电子时,理论上负极板的质量增加________g,电池中消耗的硫酸物质的量为_______mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,图甲是利用0.1mol/L的NaOH(aq)滴定三种等浓度等体积不同种一元弱酸的滴定曲线(实线),图乙是是利用NaOH(aq)滴定三种不同浓度的同种一元弱酸的滴定曲线(实线)。虚线是等浓度盐酸的滴定曲线。(已知pX=-lgX)下列说法不正确的是( )
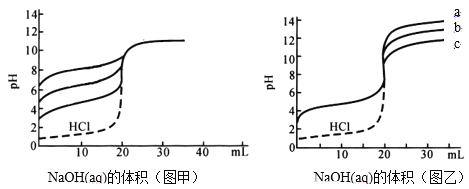
A.由图甲可以得出:一种酸的pKa越大,那么它的突跃范围越小
B.图甲滴定时可以使用酚酞(显色范围8.2-10.0)做指示剂,不可以用百里酚酞(显色范围10.0-10.6)
C.若图乙中的b曲线对应的浓度为0.1mol/L,已知其pKa=4.76。可以算出未滴定时,其pH=3.12
D.由图乙可以得出:三种一元弱酸浓度大小a>b>c
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高锰酸钾溶液常用于物质的定性检验与定量分析。
(1)实验室里欲用KMnO4固体来配制250.00 mL 0.1000 molL-1的KMnO4酸性溶液。
①需用的仪器有天平、药匙、烧杯、玻璃棒、量筒、胶头滴管、____________。
②下列操作对实验结果的影响偏高的是____________(填序号)。
a.加水定容时俯视刻度线
b.未洗涤溶解后的烧杯和玻璃棒
c.颠倒摇匀后发现凹液面低于刻度线,没有加水补到刻度线
(2)用上述酸性KMnO4溶液来测定FeSO4溶液中Fe2+的物质的量浓度。原理如下:FeSO4 + KMnO4 + H2SO4 — K2SO4 + MnSO4 + Fe2(SO4)3 + H2O (未配平),实验时应测定的数据有:量取FeSO4溶液的体积和_____________。
(3)维生素C的水溶液能使高锰酸钾溶液褪色,根据这一原理,常用高锰酸钾测定蔬菜或水果中的维生素C的含量。上述实验原理体现了维生素C具有_________。(填氧化性、还原性)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四溴乙烷(CHBr2—CHBr2)是一种无色透明液体,密度2.967g·mL-1,难溶于水,沸点244℃,可用作制造塑料的有效催化剂等。用电石(主要成分CaC2,少量CaS、Ca3P2、Ca3AS2等)和Br2等为原料制备少量四溴乙烷的装置(夹持装置已省略)如图1所示。
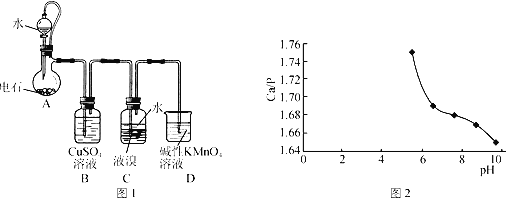
(1)装置A中CaC2能与水剧烈发生反应:CaC2+2H2O→Ca(OH)2+C2H2↑。为了得到平缓的C2H2气流,除可用饱和食盐水代替水外,还可采取的操作方法是__。
(2)装置B可除去H2S、PH3及AsH3,其中除去PH3的化学方程式为__(PH3还原性较强,氧化产物是磷酸)。
(3)装置C中在液溴液面上加入一层水的目的是__;装置C中反应已完成的现象是__;从装置C反应后的体系得到并纯化产品,需要进行的操作有__。
(4)一种制备Ca10(PO4)6(OH)2的原理为10Ca(OH)2+6H3PO4=Ca10(PO4)6(OH)2↓+18H2O。请设计用装置A得到的石灰乳等为原料制备Ca10(PO4)6(OH)2的实验方案:向烧杯中加入0.25L含0.5mol·L-1Ca(OH)2的石灰乳,_,在100℃烘箱中烘干1h。
已知:
①Ca10(PO4)6(OH)2中Ca/P比理论值为1.67。影响产品Ca/P比的主要因素有反应物投料比及反应液pH。
②在95℃,pH对Ca/P比的影响如图2所示。
③实验中须使用的试剂:含0.5mol·L-1Ca(OH)2的石灰乳、0.3mol·L-1磷酸及蒸馏水。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】目前,处理烟气中 SO2 常采用两种方法:碱液吸收法和水煤气还原法。
Ⅰ.碱液吸收法
25℃时,Kb(NH3·H2O)=1.8×10-5;H2SO3:Ka1=1.5×10-2,Ka2=1.0×10-7;Ksp(CaSO4)=7.1×10-5。
第1步:用过量的浓氨水吸收 SO2,并在空气中氧化;
第2步:加入石灰水,发生反应 Ca2++2OH-+2NH4++SO42-CaSO4↓+2NH3·H2O K。
(1)25℃时,0.1 mol·L-1(NH4)2SO3 溶液的 pH_____(填“>”“<”或“=”)7。
(2)计算第2步中反应的 K=_____。
Ⅱ.水煤气还原法
已知:①2CO(g)+SO2(g)=S(l)+2CO2(g) ΔH1=-37.0 kJ·mol-1
②2H2(g)+SO2(g)=S(l)+2H2O(g) ΔH2=+45.4 kJ·mol-1
③CO 的燃烧热ΔH3=-283 kJ·mol-1
(3)表示液态硫(S)的燃烧热的热化学方程式为_________。
(4)反应②中,正反应活化能 E1_____(填“>”“<”或“=”)ΔH2。
(5)在一定压强下,发生反应①。平衡时SO2的转化率α(SO2)与投料比的比值[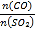 =y]、温度 T 的关系如图所示。
=y]、温度 T 的关系如图所示。
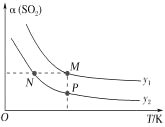
比较平衡时CO的转化率α(CO):N_____M。逆反应速率:N_____P(填“>”“<”或“=”)。
(6)某温度下,向10L恒容密闭容器中充入2molH2、2 molCO和2molSO2发生反应①、②,第5min时达到平衡,测得混合气体中CO2、H2O(g)的物质的量分别为1.6 mol、1.8 mol。
①该温度下,反应②的平衡常数K为_____。
②其他条件不变,在第 7 min 时缩小容器体积,SO2的平衡浓度_____(填“增大”“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
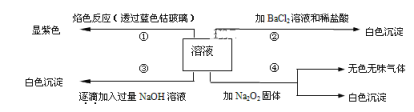
【题目】有一无色溶液,其中可能含有Fe3+、Al3+、Fe2+、Mg2+、Cu2+、Ba2+、K+、Cl-、SO42-等离子的几种,为分析其成分,取此溶液分别进行了四个实验,其操作和有关现象如下图所示:
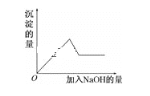
第③个实验中,生成白色沉淀的量与加入NaOH的量有如图所示的相互关系。据此可知:
(1)在原溶液中一定存在的离子有___________________________。
(2)写出第③个实验中发生反应的离子方程式___________________。
(3)第④个实验中加入Na2O2固体发生反应时氧化剂与还原剂的物质的量之比为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,在体积为3L的密闭容器中化学反应CO(g)+2H2(g)![]() CH3OH(g)达到平衡状态。
CH3OH(g)达到平衡状态。
(1)该反应的平衡常数表达式K=__;根据图,升高温度,K值将__(填“增大”、“减小”或“不变”)。
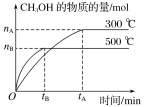
(2)500℃时,从反应开始到化学平衡状态,以H2的浓度变化表示的化学反应速率是__(用nB、tB表示)。
(3)判断该可逆反应达到化学平衡状态的标志是__(填字母,下同)。
a.υ生成(CH3OH)=υ消耗(CO) b.混合气体的密度不再改变
c.混合气体的平均相对分子质量不再改变 d.CO、H2、CH3OH的浓度均不再变化
(4)300℃时,将容器的容积压缩到原来的![]() ,在其他条件不变的情况下,对平衡体系产生的影响是____。
,在其他条件不变的情况下,对平衡体系产生的影响是____。
a.c(H2)减小 b.正反应速率加快,逆反应速率减慢
c.CH3OH的物质的量增加 d.重新平衡时![]() 减小
减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:还原性HSO3->I-,氧化性IO3->I2>SO42-,在含0.3molNaHSO3的溶液中逐滴加入KIO3溶液.加入KIO3和析出I2的物质的量的关系曲线如图所示.下列说法不正确的是( )
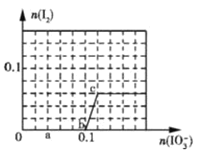
A.0~b间的反应可用如下离子方程式表示:3HSO3-+IO3- ═3SO42-+I-+3H+
B.a点时消耗NaHSO3的物质的量为0.12mol
C.当溶液中的I-为0.04 mol时,加入的KIO3只能是0.04mol
D.b点时的还原产物可能是KI或NaI,b~c间的还原产物是I2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com