
【题目】Fe3+与HCO3-不能大量共存是它们相互促进水解完全造成的么?_________
【答案】是
【解析】
Fe3+水解消耗OH-,HCO3-水解消耗H+,结合溶液的酸碱性及离子浓度变化分析。
Fe3+是强酸盐电离产生,Al3+会发生水解反应,消耗水电离产生的OH-,水解方程式为:Fe3++3H2O![]() Fe(OH)3+3H+,水解产生H+,使溶液显酸性;
Fe(OH)3+3H+,水解产生H+,使溶液显酸性;
HCO3-是强碱盐电离产生,HCO3-会发生水解反应,消耗水电离产生的H+产生H2CO3,水解方程式为:HCO3-+H2O![]() H2CO3+OH-,水解产生OH-,使溶液显碱性;二者在同一溶液中,水解产生的H+、OH-发生中和反应,使二者水解程度增大、完全,最终产生Al(OH)3沉淀和CO2气体,反应方程式为:Fe3++3HCO3-=Fe(OH)3↓+3CO2↑,可见二者由于盐的双水解反应而不能大量共存。
H2CO3+OH-,水解产生OH-,使溶液显碱性;二者在同一溶液中,水解产生的H+、OH-发生中和反应,使二者水解程度增大、完全,最终产生Al(OH)3沉淀和CO2气体,反应方程式为:Fe3++3HCO3-=Fe(OH)3↓+3CO2↑,可见二者由于盐的双水解反应而不能大量共存。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】设NA代表阿伏加德罗常数的值,下列说法错误的是( )
A.将6.4gSO2溶于水,溶液中H2SO3、HSO3-、SO32-的个数之和为0.1NA
B.![]() 和
和![]() 的混合物中所含阴离子
的混合物中所含阴离子![]() 总数为0.1NA
总数为0.1NA
C.19.2g铜完全溶于一定浓度的硝酸中,转移电子数一定为0.6NA
D.标准状况下,![]() 和
和![]() 的混合气体中所含氢原子数为3NA
的混合气体中所含氢原子数为3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数的值,下列叙述正确的是( )
A.常温下pH为2的醋酸溶液中由H2O电离出的H+数为10-12NA
B.标准状况下,28gCO与22.4LSO3所含分子数都为NA
C.50mL8mol/L的浓盐酸与足量的MnO2加热反应,生成Cl2的分子数为0.1NA
D.在反应S+2KNO3+3C![]() K2S+N2↑+3CO2↑中,每生成2NA个气体分子,参加反应的氧化剂的物质的量为1.5mol
K2S+N2↑+3CO2↑中,每生成2NA个气体分子,参加反应的氧化剂的物质的量为1.5mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在1800K时,2Fe(s)+3/2O2(g)=Fe2O3(s) H= -354.2kJ/mol;
3Fe(s)+2O2(g)=Fe3O4(s) H= -550.9kJ/mol
则反应:2Fe3O4(s)+1/2O2(g) === 3Fe2O3(s)的H =_____ kJ·mol1,四氧化三铁在充满氧气的集气瓶中反应生成Fe2O3_____(填“能”或“不能”)自发进行。
(2)2018年是合成氨工业先驱哈伯(PHaber)获得诺贝尔奖100周年。N2和H2生成NH3的反应为:1/2N2(g)+3/2H2(g) ![]() NH3(g) △H(298K)= - 46.2KJmol-1,在Fe催化剂作用下的反应历程如下(*表示吸附态)
NH3(g) △H(298K)= - 46.2KJmol-1,在Fe催化剂作用下的反应历程如下(*表示吸附态)
化学吸附:N2(g)→2N*;H2(g)→2H*;
表面反应:N*+ H*![]() NH*;NH*+ H*
NH*;NH*+ H*![]() NH2*;NH2* + H*
NH2*;NH2* + H*![]() NH3*
NH3*
脱附:NH3*![]() NH3(g)
NH3(g)
其中, N2的吸附分解反应活化能高、速率慢,决定了合成氨的整体反应速率。 请回答:
①利于提高合成氨平衡产率的条件有__________。
A.低温 B.高温 C.低压 D.高压 E.催化剂
②实际生产中,常用Fe作催化剂,控制温度773K,压强3.0 ×105Pa,原料中N2和H2物质的量之比为1:2.8。
分析说明原料气中N2过量的两个理由_________;_____________。
③关于合成氨工艺的下列理解,正确的是_______。
A.合成氨反应在不同温度下的△H和△S都小于零
B.当温度、压强一定时,在原料气(N2和H2的比例不变)中添加少量惰性气体,有利于提高平衡转化率
C.基于NH3有较强的分子间作用力可将其液化,不断将液氨移去,利于反应正向进行
D.分离空气可得N2,通过天然气和水蒸气转化可得H2,原料气须经过净化处理,以防止催化剂中毒和安全事故发
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、R、W 均为周期表中前四周期的元素,其原子序数依次增大;X2-和 Y+有相 同的核外电子排布;Z 的氢化物的沸点比其上一周期同族元素氢化物的沸点低;R 的基 态原子在前四周期元素的基态原子中单电子数最多;W 为金属元素,X 与 W 形成的某 种化合物与 Z 的氢化物的浓溶液加热时反应可用于实验室制取 Z 的气态单质。回答下 列问题(相关回答均用元素符号表示):
(1)R 的基态原子的核外电子排布式是__________________。
(2)Z 的氢化物的沸点比其上一周期同族元素氢化物的沸点低的原因是______________。
(3)X 与 Z 中电负性较大的是_____ 。Z 的某种含氧酸盐常用于实验室中 X 的单质的 制取,此酸根离子的空间构型是______________,此离子中含有的化学键类型 是_________ ,X—Z—X 的键角_______109.5°(填“>”、“=”或“<”)。
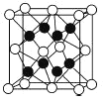
(4)X 与 Y 形成的化合物 Y2X 的晶胞如图。其中 X 离子的配位数 为___________,以相距一个 X 离子最近的所有 Y 离子为顶点构成的几何体为___________ 。该化合物与 MgO 相比,熔点较高的是____________。
(5)已知该化合物的晶胞边长为 a pm,则该化合物的密度为________________g·cm-3(只要求列算式,不必计算出数值,阿伏加德岁常数的数值为 NA)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】思维辨析:
(1)乙醇易溶于水,是因为乙醇分子间存在氢键。________
(2)HO—CH2CH2—OH也可与Na反应,断裂C—O键。________
(3)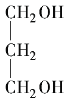 的命名是1,3二丙醇。________
的命名是1,3二丙醇。________
(4)1丙醇在氢氧化钠溶液中加热也可发生消去反应。________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数,下列说法正确的是( )
A. 1 molCH3COOH与1mol CH3CH2OH在浓硫酸共热下生成的乙酸乙酯分子数为NA
B. 现有乙烯、丙烯、丁烯的混合气体共14g,其原子数为3NA
C. 7.8g ![]() 中含有的碳碳双键数为0.3NA
中含有的碳碳双键数为0.3NA
D. 标准状况下,11.2L的戊烷所含的分子数为0.5NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一个容积为2 L的密闭容器中,加入0.8 mol的A2气体和0.6 mol B2气体,一定条件下发生如下反应:A2(g)+B2(g)![]() 2AB(g) ΔH<0,反应中各物质的浓度随时间的变化情况如图所示,下列说法不正确的是
2AB(g) ΔH<0,反应中各物质的浓度随时间的变化情况如图所示,下列说法不正确的是

A. 图中a点的值为0.15 B. 该反应的平衡常数K=0.03
C. 温度升高,平衡常数K值减小 D. 平衡时A2的转化率为62.5%
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com