
 夺冠金卷全能练考系列答案
夺冠金卷全能练考系列答案科目:高中化学 来源:不详 题型:单选题
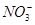 、Fe3+、
、Fe3+、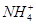 、H+和H2O六种粒子,属于同一氧化还原反应中的反应物和生成物,下列叙述不正确的是
、H+和H2O六种粒子,属于同一氧化还原反应中的反应物和生成物,下列叙述不正确的是| A.氧化剂和还原剂的物质的量之比为1∶8 |
| B.该反应说明Fe(NO3)2溶液不宜加酸酸化 |
C.每1 mol 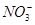 发生氧化反应,转移8 mol e- 发生氧化反应,转移8 mol e- |
| D.若把该反应设计为原电池,则负极反应为Fe2+-e-=Fe3+ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.22.1 g | B.27.2 g |
| C.30 g | D.无法计算 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.Na2O2在上述反应中只作氧化剂 |
| B.Na2FeO4既是氧化产物又是还原产物 |
| C.Na2FeO4处理水时,既能杀菌,又能产生胶体净水 |
| D.2 mol FeSO4发生反应时,共有10 mol电子发生转移 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题



查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.消耗硫酸亚铁铵的物质的量为n(2-x)mol |
B.处理废水中Cr2O72- 的物质的量为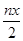 mol mol |
| C.反应中转移的电子为3nx mol |
| D.在FeO·FeyCrxO3中3x=y |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.0.02 mol | B.0.08 mol |
| C.0.10 mol | D.0.16 mol |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.0.15 mol/L | B.0.225 mol/L |
| C.0.30 mol/L | D.0.45 mol/L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com