
| A. | 从左往右,第三周期主族元素的原子半径和离子半径均逐渐减小 | |
| B. | 从左往右,第三周期主族元素氧化物的水化物的碱性逐渐减弱酸性逐渐增强 | |
| C. | 从上往下,第ⅥA元素气体氢化物的热稳定性逐渐增强 | |
| D. | 从上往下,第ⅥA元素气体氢化物的还原性逐渐增强 |
分析 A、第三周期中,阴离子半径大于阳离子半径,具有相同排布的离子原子序数大的离子半径小;
B、第三周期从钠到氯,金属性在减弱,非金属性在增强;
C、同主族元素从上往下非金属性减弱,非金属性越强氢化物稳定性越强;
D、元素的非金属性越强,对应的氢化物还原性越弱.
解答 解:A、第三周期中,阴离子半径大于阳离子半径,具有相同排布的离子原子序数大的离子半径小,如第三周期中铝离子半径最小,故A错误;
B、第三周期从钠到氯,金属性在减弱,非金属性在增强,则最高价氧化物的水化物碱性逐渐减弱,酸性逐渐增强,故B错误;
C、同主族元素从上往下非金属性减弱,非金属性越强氢化物稳定性越弱,故C错误;
D、元素的非金属性越强,对应的氢化物还原性越弱,第ⅦA元素从上到下,元素的非金属性逐渐减弱,其氢化物的还原性逐渐增强,故D正确.
故选D.
点评 本题考查元素周期表、周期律知识,为高频考点,侧重于学生的分析能力的考查,注意把握元素的性质的递变规律,难度不大.


 状元坊全程突破导练测系列答案
状元坊全程突破导练测系列答案 直通贵州名校周测月考直通名校系列答案
直通贵州名校周测月考直通名校系列答案科目:高中化学 来源: 题型:选择题
| A. | pH=11的Na0H和Na2S溶液中水的电离程度前者大于后者 | |
| B. | 实验室配制氯化亚铁溶液时,将氯化亚铁先溶解在盐酸中,然后用蒸馏水稀释并加入少量铁粉 | |
| C. | 25℃,Cu(OH)2在水中的溶度积和溶解度比其在Cu(NO3)2溶液中的大 | |
| D. | 向FeCl3+3KSCN?Fe(SCN)3+3KCl平衡体系中加入少量KCl 固体,溶液血红色变浅 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.3 mol | B. | 0.15 mol | ||
| C. | 大于0.15mol,小于0.3mol | D. | 小于0.15mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
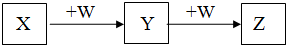 X、Y、Z、W均为中学化学的常见物质,一定条件下它们之间有如图转化关系(其它产物已略去),下列说法不正确的是( )
X、Y、Z、W均为中学化学的常见物质,一定条件下它们之间有如图转化关系(其它产物已略去),下列说法不正确的是( )| A. | 若W是氢氧化钠,则X与Z可反应生成Y | |
| B. | 若X是硝酸银溶液,则W是氨水 | |
| C. | 若X是H2S,则X、Z的相对分子质量相差可能为30或46 | |
| D. | 若W是单质铁,则Z是FeCl3 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | PVC(聚氯乙烯)是生活中常用的一种管材,其中聚氯乙烯中含有碳碳双键结构,所以可以使溴水褪色 | |
| B. | 乙炔可以作为氧炔焰的原料气体,是因为其燃烧时火焰的温度很高 | |
| C. | 聚乙烯常用于制造生活常见的塑料制品,其中聚乙烯属于纯净物 | |
| D. | 氯仿(三氯甲烷)是工业上常用的一种溶剂,一般用甲烷和氯气按1:3反应即可生成纯净的氯仿 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙醇完全燃烧生成CO2和H2O | |
| B. | 0.1mol乙醇与足量的钠反应生成0.5mol氢气 | |
| C. | 乙醇能溶于水 | |
| D. | 乙醇能脱水. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 其化学式改写为氧化物的形式为2CaO•3MgO•Fe2O3•8SiO2•H2O | |
| B. | 它能够抵抗任何酸碱的腐蚀 | |
| C. | 其中铁元素的化合价为+3 | |
| D. | 其中铁元素的化合价为+2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com