
【题目】在2 L密闭容器中,加入等物质的量的NO和O2,800℃时发生反应:2NO(g)+O2(g)→2NO2(g),其中n(NO)随时间的变化如表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(1)上述反应________(填“是”或“不是”)可逆反应。
(2)如图所示,表示NO2变化曲线的是______。
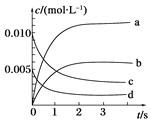
(3)用O2表示从0~2s内该反应的平均速率v=________,5s时O2的转化率为_____________。
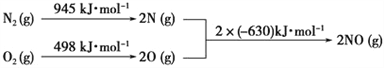
(4)NOx是汽车尾气中的主要污染物之一。汽车发动机工作时会引发N2和O2反应,其能量变化如图所示。写出该反应的热化学方程式:_______________________。
(5)以N2和H2为反应物,盐酸酸化的NH4Cl溶液为电解质的原电池,工作原理如下图所示,下列说法不正确的是___________。
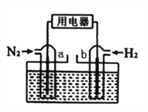
A.b电极为负极
B.反应过程中,溶液中的Cl-向a电极移动
C.a电极的电极反应式为:N2+6e-+8H+=2NH4+
D.电池反应为N2+3H2+2HCl=2NH4Cl
【答案】 是 b 1.5×10-3mol·(L·s)-1 65% N2(g)+O2(g)=2NO(g) △H=+183kJ·mol-1 B
【解析】(1)根据图表所示,3 s后,n(NO)不再发生变化,达平衡状态,为可逆反应;答案:是;
(2)反应达平衡后,n(NO)= 0.007 mol,消耗n(NO)= 0.020-0.007=0.013 mol,生成n(NO2)=0.013 mol,c((NO2)=0.013/2=0.0065 mol /L,根 据 图 像 可 知,答 案 选 b;
(3)0~2s内,n(NO)减少了0.020-0.008=0.012 mol,n(O2)减少了0.012/2 =0.006mol,c (O2)= 0.006/2=0.003 mol /L, v(O2)=0.003/2=1.5×10-3mol·(L·s)-1;5s时,n(NO)减少了0.020-0.007=0.013 mol,n(O2)减少了0.013/2 =0.0065mol,O2的转化率为=0.0065/0.010=65%;
(4)1molN2断键吸收的能量为945 kJ·mol-1,1molO2断键吸收的能量为 498 kJ·mol-1,生成 2molNO放出的能量2×630 kJ·mol-1;根据能量守恒规律:△H=945+ 498-2×630=+183kJ·mol-1;正确答案为+183kJ·mol-1;
(5)氮气和氢气反应合成氨气,氮气做氧化剂,氢气做还原剂,通入氮气的一极为正极,通入氢气的一极为负极,b电极为负极, A正确;溶液中Cl-向负极移动,即向b电极移动,B错误;C.a电极为正极,得电子,电极反应式为:N2+6e-+8H+=2NH4+;C正确;D.氮气和氢气在酸性环境下生成了氯化铵,电池反应为N2+3H2+2HCl=2NH4Cl,D正确;答案选B;


 100分闯关期末冲刺系列答案
100分闯关期末冲刺系列答案科目:高中化学 来源: 题型:
【题目】下列式子属于水解反应,且溶液呈酸性的是 ( )
A. HCO3- + H2O ![]() H3O+ + CO32- B. Fe3+ + 3H2O
H3O+ + CO32- B. Fe3+ + 3H2O ![]() Fe(OH)3 + 3H+
Fe(OH)3 + 3H+
C. HS- + H2O ![]() H2S + OH- D. NH4+ + OH-
H2S + OH- D. NH4+ + OH- ![]() NH3↑+ H2O
NH3↑+ H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学在做实验时引发了镁失火,她立即拿起二氧化碳灭火器欲把火扑灭,却被实验老师及时制止。原因是CO2可以支持镁燃烧,发生2Mg+CO2![]() 2MgO+C,下列关于该反应的判断正确的是( )
2MgO+C,下列关于该反应的判断正确的是( )
A. Mg元素化合价由0价升高到+2价,所以MgO是还原产物
B. 由此反应可以判断氧化性:CO2>MgO,还原性:Mg>C
C. CO2作氧化剂,表现氧化性,发生氧化反应
D. Mg原子失去的电子数目等于氧原子得到的电子数目
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA表示阿伏加德罗常数的值。下列说法正确的是
A. 标准状况下,2.24L三氯甲烷中所含分子数为NA
B. 1molH2与1molI2(g)于密闭容器中反应,生成的H-I键数为2NA
C. 常温下,0.1molFe投入到足量浓硫酸中反应,转移的电子数为0.3NA
D. 8.8g乙酸乙酯和乙醛(CH3CHO)的混合物中含有的C原子数为0.4NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】今年在全球肆虐的禽流感又称为真性鸡瘟,包括中国在内的一些国家和地区发生了人类因感染禽流感病毒死亡的病例。据专家分析,该病毒中有70%-75%的化学成分为蛋白质,因此要重视高温杀毒.在56℃时加热30分钟,60℃时加热10分钟,70℃加热几分钟,阳光直射40-48小时均可杀死禽流感病毒。专家的上述建议是利用了蛋白质性质中的
A. 盐析 B. 变性 C. 水解 D. 颜色反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸盐和金属硫化物在工农业生产中有广泛的应用。
(1)已知:
反应Ⅰ:CaSO4(s)+CO(g)=CaO(s)+SO2(g)+CO2(g)△H1=+218.4 kJ·mol-1
反应Ⅱ:CaSO4(s)+4CO(g)=CaS(s)+4CO2(g) △H2=-175.6kJ·mol-1
反应 Ⅲ:3CaSO4(s)+CaS(s)=4CaO(s)+4SO2(g) (B) △H3
①△H3=__________。
②能使反应Ⅰ、Ⅱ速率加快的措施有____________________________________(写出两条)。
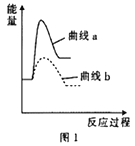
③已知某温度下反应Ⅰ的反应速率小于反应Ⅱ的反应速率,则图1中曲线a表示__________ (填“反应Ⅰ”或“反应Ⅱ”)。
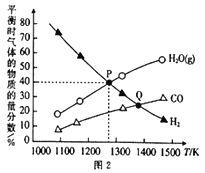
(2)在2L密闭容器中,加入0.1molMoS2(硫化钼)、0.2molNa2CO3和0.4molH2,发生反应MoS2(s)+2Na2CO3 (s)+4H2(g)![]() Mo(s)+2CO(g)+4H2O(g)+2Na2S(s),达到平衡时三种气体的物质的量分数随温度变化的曲 线如图2所示。
Mo(s)+2CO(g)+4H2O(g)+2Na2S(s),达到平衡时三种气体的物质的量分数随温度变化的曲 线如图2所示。
①反应速率:P点______ Q点(填“<” “>”或“=”),其判断理由是_____________。
②气体总压:P点__Q点(填“<” “>”或“=”),其判断理由是_____________。
③P点对应温度下,H2的平衡转化率为__________,平衡常数K=__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用铝锂钴废料(主要成分为Co3O4,还含有少量铝箔、LiCoO2等杂质)回收CoO的工艺流程如下:
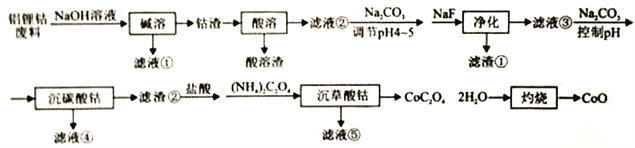
回答下列问题:
(1)“碱溶”的目的是:________________。
(2)不同浸出剂“酸溶”实验结果见下表,根据数据和物质性质应选择的浸出剂是___________(填序号),理由是__________ (用Co3O4参与反应的离子方程式表示)。
浸出剂 | 浸出液化学成分/(g·L-1) | 钴浸出率/% | |
Co | Al | ||
(a)HCI | 80.84 | 5.68 | 98.4 |
(b)H2SO4 | 65.0 | 6.22 | 72.3 |
(c)H2SO4+ Na2S2O3 | 84.91 | 5.96 | 98.0 |
(3)“净化”产生的滤渣为____________(填化学式),滤液③中c(F-)=4.0×10-3mol·L-1,则“净化”后残余c(Li+)=___________。LiF与Li2CO3的Ksp分别为1.8×10-3、1.7×10-3。
(4)若滤液④中含Co2+为5.9×10-2g·L-1,“沉碳酸钴"应控制pH不高于___________。Co(OH)2的Ksp为1.0×10-15。
(5)“沉碳酸钴“→“沉草酸钻”的目的是___________。
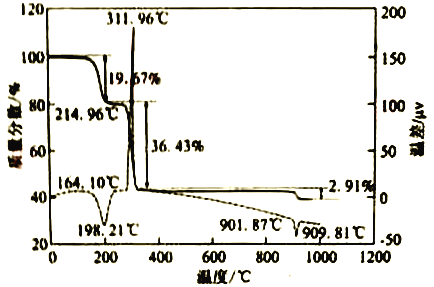
(6)CaC2O4·H2O在空气氛围中的热重曲线如下图。在311.96℃附近有个很强的放热峰的原因是______。900℃发生反应的化学方程式为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)某混合溶液中只含有下列几种离子(不考虑水的电离):Na+、Mg2+、Al3+、Cl-、SO42-,若Na+、Mg2+、Cl-、SO42-的物质的量浓度依次为 0.2 mol/L、0.25 mol/L、0.5 mol/L、0.25mol/L,则 c(Al3+)=________ 。
(2) 某物质 A 加热时按化学方程式 2A═2B+C+3D 分解,产物均为气体,测得由生成物组成的混 合物气体对 H2 的相对密度为 20,则反应物 A 的摩尔质量为_____ 。
(3)在标准状况下,将 VL A 气体(摩尔质量为 Mg/mol)溶于 0.1L 水中,所得溶液的密度为ρg/cm3,则此溶液的物质的量浓度为_________mol·L-1
A.1000Vρ/(MV+22400)mol·L-1 B.Vρ/(MV+22400)mol·L-1
C.100VρM/(MV+22400)mol·L-1 D.MV/22.4(V+0.1) ρmol·L-1
(4)生态农业涉及农家肥料的综合利用.某种肥料经发酵得到一种含有甲烷、二氧化碳、氮气 的混合气体 8.96L(标准状况).该气体通过盛有红色 CuO 粉末的硬质玻璃管,发生的反应为:CH4+4CuO![]() CO2↑+2H2O↑+4Cu,.当甲烷完全反应后,硬质玻璃管的质量减轻了 4.8g。将反应后气体通入 2L 0.1mol/L 的澄清 Ca(OH)2 溶液,充分吸收,生成沉淀 10g.求:
CO2↑+2H2O↑+4Cu,.当甲烷完全反应后,硬质玻璃管的质量减轻了 4.8g。将反应后气体通入 2L 0.1mol/L 的澄清 Ca(OH)2 溶液,充分吸收,生成沉淀 10g.求:
①原混合气体中甲烷的体积(标准状况)___________________________________________________
②反应后的气体中 CO2 的物质的量为_______________________
(5)为确定铬钾矾 xK2SO4·yCr2(SO4)3·zH2O的分子式,配成含此物质 31.28g 的溶 液 400mL,取 200mL 的溶液加入 1mol/L 的Ba(NO3)2溶液 100mL,生成沉淀,过滤后滤液中 加入 0.1mol/L H2SO4 溶液,消耗 200mL 硫酸时沉淀恰好完全,用过量氨水处理剩余的 200mL 溶液,生成 Cr(OH)3 沉淀 4.12g,试确定 x、y、z 的值.____________________________________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com