
【题目】对有机物性质进行探究,下列描述不正确的是
A.对甲基苯甲醛(![]() )能使酸性高锰酸钾溶液褪色,说明它含有醛基
)能使酸性高锰酸钾溶液褪色,说明它含有醛基
B.将铜丝在酒精灯的外焰上加热变黑后再移至内焰,铜丝又恢复到原来的红色
C.向2mL10%的NaOH溶液中滴几滴CuSO4溶液,再加入乙醛溶液加热有红色沉淀产生
D.向苯酚溶液中滴加几滴稀溴水出现白色沉淀
【答案】AD
【解析】
A.对甲基苯甲醛(![]() )能使酸性高锰酸钾溶液褪色,有可能是苯环上的甲基被酸性高锰酸钾溶液氧化为-COOH而褪色,也有可能是醛基被酸性高锰酸钾溶液氧化而褪色,所以不能说明它含有醛基,故A错误;
)能使酸性高锰酸钾溶液褪色,有可能是苯环上的甲基被酸性高锰酸钾溶液氧化为-COOH而褪色,也有可能是醛基被酸性高锰酸钾溶液氧化而褪色,所以不能说明它含有醛基,故A错误;
B.铜丝在酒精灯外焰加热后产生氧化铜变黑,再移至内焰,内焰含有乙醇,铜丝表面黑色的氧化铜被还原为单质铜,因此铜丝恢复成原来的红色,故B正确;
C.向2mL10%的NaOH溶液中滴几滴CuSO4溶液生成氢氧化铜且氢氧化钠过量,溶液呈碱性,再加入乙醛溶液加热,乙醛和新制的氢氧化铜在碱性条件下反应产生红色沉淀氧化亚铜,故C正确;
D.在苯酚溶液中滴加几滴稀溴水产生的三溴苯酚溶解在过量的苯酚溶液中不会出现白色沉淀,只有将少量的苯酚溶液中滴入浓溴水中才能产生的三溴苯酚沉淀,故D错误;
答案选AD。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】根据图示,回答下列问题:

(1)按要求写出下列有机物的分子结构。
乙烯的电子式__________,
乙烷的分子式________,
乙醇的结构式___________,
氯乙烷的结构简式________。
(2)写出②、④两步反应的化学方程式,并注明反应类型
②_______________________,反应类型_______________。
④_______________________,反应类型_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A的产量通常用来衡量一个国家的石油化工水平,现以A为主要原料合成一种具有果香味的物质E,其合成路线如下图所示。
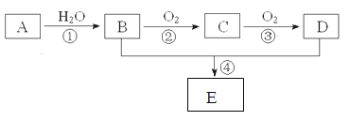
请回答下列问题:(电子式和化学方程式书写每空2分,其余每空1分)
(1)写出A的电子式 ,B、D分子中的官能团名称分别是 、 。
(2)写出下列反应的化学方程式,并注明反应类型:
① , ;
② , ;
④ , 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.乳酸薄荷醇酯 ![]() 仅能发生水解、氧化、消去反应
仅能发生水解、氧化、消去反应
B.乙醛和丙烯醛![]() 不是同系物,但它们与氢气充分反应后的产物是同系物
不是同系物,但它们与氢气充分反应后的产物是同系物
C.甲醇、乙醇、乙二醇的沸点逐渐升高
D.甲苯、乙烯均能使酸性 KMnO4 溶液褪色,但反应原理不同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C为短周期元素,在周期表中所处的位置如图所示。
A | C | |
B |
A、C两元素的原子核外电子数之和等于B原子的质子数。
(1)写出A、B元素的名称 、 。
(2)B位于元素周期表中第 周期第 族。
(3)C的原子结构示意图为 。
(4)写出A的气态氢化物与其最高价氧化物对应的水化物反应的化学方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1909年化学家哈伯在实验室首次合成了氨。2007年化学家格哈德·埃特尔在哈伯研究所证实了氢气与氮气在固体表面合成氨的反应过程,示意如下图:
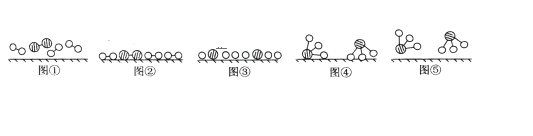
(1)图⑤表示生成的NH3离开催化剂表面,图③的含义分别是_____________。
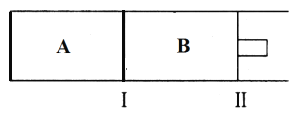
(2)500℃下,在A、B两个容器中均发生合成氨的反应。起始两容器充入两气体两相同,体积相同,隔板Ⅰ固定不动,活塞Ⅱ可自由移动。
①两容器的N2的转化率关系为αA____αB(填“>”、“<”或“=”)
②在B容器中,反应达到平衡的标志有________。
A 容器中气体压强不再发生变化
B 容器中气体密度不再发生变化
C 容器中气体平均摩尔质量不再发生变化
③当合成氨在容器B中达平衡时,测得其中含有1.0molN2,0.4molH2,0.4molNH3,此时容积为2.0L。保持温度和压强不变,向此容器中通入0.36molN2,平衡将____________(填“正向”、“逆向”或“不”)移动。
④向A、B两容器中均通入xmolN2和ymolH2,初始A、B容积相同,并保持温度不变。若要平衡时保持N2在A、B两容器中的体积分数相同,则x与y之间必须满足的关系式为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于可逆反应:2SO2(g)+O2(g)![]() 2SO3(g),下列措施能使反应物中活化分子百分数、化学反应速率和化学平衡常数都变化的是( )
2SO3(g),下列措施能使反应物中活化分子百分数、化学反应速率和化学平衡常数都变化的是( )
A. 增大压强 B. 升高温度 C. 使用催化剂 D. 多充O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,关于pH相同的氨水和氢氧化钠溶液,下列说法正确的是( )
A.c(NaOH)>c(NH3·H2O)
B.c(![]() )=c(Na+)=c(OH-)
)=c(Na+)=c(OH-)
C.两种溶液中水的电离程度相同
D.等体积的氨水和氢氧化钠溶液分别与相同浓度的盐酸完全中和时,消耗的盐酸体积相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在药物制剂中,抗氧剂与被保护的药物在与![]() 发生反应时具有竞争性,抗氧性强弱主要取决于其氧化反应的速率。
发生反应时具有竞争性,抗氧性强弱主要取决于其氧化反应的速率。![]() 、
、![]() 和
和![]() 是三种常用的抗氧剂。已知:
是三种常用的抗氧剂。已知:![]() 溶于水发生反应:
溶于水发生反应:![]() ;
;![]() 以原溶液和一定量的酸或碱混合,保持总体积不变的方式调节pH。
以原溶液和一定量的酸或碱混合,保持总体积不变的方式调节pH。
实验用品 | 实验操作和现象 |
| 实验1:溶液 |
| 实验2:溶液
|
| 实验3:调溶液 |
下列说法中不正确的是 ![]()
A.![]() 溶液显碱性,原因是
溶液显碱性,原因是![]()
B.![]() 溶液中
溶液中![]() 的电离程度大于水解程度
的电离程度大于水解程度
C.实验2说明,![]() 在
在![]() 时抗氧性最强
时抗氧性最强
D.实验3中,三种溶液在pH相同时起抗氧作用的微粒种类和浓度相同,因此反应速率相同
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com