
【题目】1909年化学家哈伯在实验室首次合成了氨。2007年化学家格哈德·埃特尔在哈伯研究所证实了氢气与氮气在固体表面合成氨的反应过程,示意如下图:
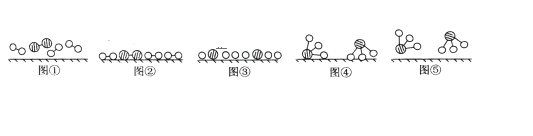
(1)图⑤表示生成的NH3离开催化剂表面,图③的含义分别是_____________。
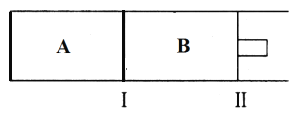
(2)500℃下,在A、B两个容器中均发生合成氨的反应。起始两容器充入两气体两相同,体积相同,隔板Ⅰ固定不动,活塞Ⅱ可自由移动。
①两容器的N2的转化率关系为αA____αB(填“>”、“<”或“=”)
②在B容器中,反应达到平衡的标志有________。
A 容器中气体压强不再发生变化
B 容器中气体密度不再发生变化
C 容器中气体平均摩尔质量不再发生变化
③当合成氨在容器B中达平衡时,测得其中含有1.0molN2,0.4molH2,0.4molNH3,此时容积为2.0L。保持温度和压强不变,向此容器中通入0.36molN2,平衡将____________(填“正向”、“逆向”或“不”)移动。
④向A、B两容器中均通入xmolN2和ymolH2,初始A、B容积相同,并保持温度不变。若要平衡时保持N2在A、B两容器中的体积分数相同,则x与y之间必须满足的关系式为__________。
【答案】氮气,氢气在催化剂表面断键 < BC 逆向 X=Y
【解析】
(1)从图中直接观察,图②中分子内原子间存在短线,图③中原子间的短线消失,显然是断键。
(2) ①A容积固定,B压强固定,所以B相当于A加压。
②判断平衡状态时,因为提供的量都是体系的总量,所以只要分析此总量是否为变量,若为变量,变量不变即为平衡状态。
③利用三段式求出平衡时各量,然后求出平衡常数,再利用浓度商与平衡常数的数值关系,确定平衡移动的方向。
④利用三段式建立等量关系,求解。
(1)比较各图中分子的变化、分子间化学键的变化,图⑤表示生成的NH3离开催化剂表面,图③的含义分别是氮气、氢气在催化剂表面断键;
答案:氮气、氢气在催化剂表面断键。
(2)①随着反应的不断进行,容器A内气体的压强不断减小,容器B相当于容器A加压,平衡正向移动,N2的转化率增大,所以两容器的N2的转化率关系为αA< αB;
答案:<;
②A. 随着反应的进行,容器中气体压强始终不变,所以压强不变不一定达平衡状态;
B. 随着反应的进行,体积改变、质量不变,所以若容器中气体密度不再发生变化,则达平衡状态;
C. 随着反应的进行,气体的质量不变,但物质的量改变,所以若容器中气体平均摩尔质量不再发生变化,则反应达平衡状态。
答案:BC。
③K=![]() 。
。
压强一定时,1.8mol气体,体积为2.0L;向容器内通入0.36molN2,则气体共2.16mol,体积应为2.4L。
Q= >10,所以平衡逆向移动;
>10,所以平衡逆向移动;
答案:逆向。
④设A、B容器中,N2的变化量分别 为a、b
N2 + 3H2 ![]() 2NH3
2NH3
起始量 x y 0
变化量 a 3a 2a
平衡量 a-a y-3a 2a
N2 + 3H2 ![]() 2NH3
2NH3
起始量 x y 0
变化量 b 3b 2b
平衡量 x-b y-3b 2b
依题意得:![]() ,
,
解之得:![]()
所以:x=y;
答案:x=y。


 直通贵州名校周测月考直通名校系列答案
直通贵州名校周测月考直通名校系列答案科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A.将5.85gNaCl晶体溶入100mL水中,制得0.1mol/LNaCl溶液
B.将1体积cmol/L硫酸溶液用水稀释为5体积,得到0.2cmol/L硫酸溶液
C.将25g无水CuSO4溶于水制成100mL溶液,其浓度为1mol/L
D.将wga%NaCl溶液蒸发掉![]() g水,一定得到2a%NaCl溶液
g水,一定得到2a%NaCl溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁是人体内不可或缺的微量元素,其配合物的研究也是当今科研的重点之一。
![]() 基态Fe原子的价层电子轨道表达式为________________________________;同周期元素中,基态原子的未成对电子数比Fe多的元素为________
基态Fe原子的价层电子轨道表达式为________________________________;同周期元素中,基态原子的未成对电子数比Fe多的元素为________![]() 填元素符号
填元素符号![]() 。
。
![]() 常温下,五羰基铁
常温下,五羰基铁![]() 为黄色液体,其晶体类型为________________;CO与
为黄色液体,其晶体类型为________________;CO与![]() 互为等电子体,二者中沸点较高的是________,原因为________________________。
互为等电子体,二者中沸点较高的是________,原因为________________________。
![]() 普鲁士蓝的化学式为
普鲁士蓝的化学式为![]() ,碳原子与
,碳原子与![]() 形成配位键,其中提供孤电子对的是________
形成配位键,其中提供孤电子对的是________![]() 填元素符号
填元素符号![]() ,
,![]() 中碳原子的杂化方式为________,1mol普鲁士蓝中所含
中碳原子的杂化方式为________,1mol普鲁士蓝中所含![]() 键的数目为________________。
键的数目为________________。
![]() 邻羟基苯甲醛
邻羟基苯甲醛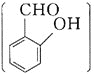 和对羟基苯甲醛
和对羟基苯甲醛 均能与
均能与![]() 溶液反应生成紫色配合物。对羟基苯甲醛在水中的溶解度略大于邻羟基苯甲醛在水中的溶解度,原因为________________________________________________________。
溶液反应生成紫色配合物。对羟基苯甲醛在水中的溶解度略大于邻羟基苯甲醛在水中的溶解度,原因为________________________________________________________。
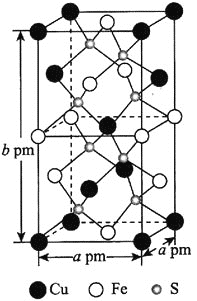
![]() 某含铁化合物的长方体晶胞结构如图所示,该化合物的化学式为________________,晶胞中距离Fe原子最近的S原子有________个,若阿伏加德罗常数的值为
某含铁化合物的长方体晶胞结构如图所示,该化合物的化学式为________________,晶胞中距离Fe原子最近的S原子有________个,若阿伏加德罗常数的值为![]() ,则该晶体的密度为________________________
,则该晶体的密度为________________________![]() 用含有
用含有![]() 、a、b的代数式表示
、a、b的代数式表示![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】普伐他汀是一种调节血脂的药物,其结构如图所示。下列关于普伐他汀的性质描述正确的是
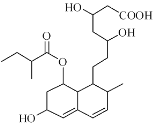
A.能发生加成、取代、消去反应
B.不能使酸性KMnO4溶液褪色
C.能与FeCl3溶液发生显色反应
D.1mol该物质最多可与3molNaOH反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对有机物性质进行探究,下列描述不正确的是
A.对甲基苯甲醛(![]() )能使酸性高锰酸钾溶液褪色,说明它含有醛基
)能使酸性高锰酸钾溶液褪色,说明它含有醛基
B.将铜丝在酒精灯的外焰上加热变黑后再移至内焰,铜丝又恢复到原来的红色
C.向2mL10%的NaOH溶液中滴几滴CuSO4溶液,再加入乙醛溶液加热有红色沉淀产生
D.向苯酚溶液中滴加几滴稀溴水出现白色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活、人类生产、社会可持续发展密切相关,下列叙述正确的是
A.塑料、有机玻璃、光导纤维、碳纤维都是新型有机高分子材料
B.磁性氧化铁可用于制备红色颜料和油漆
C.用明矾溶液可清除铜镜表面的铜锈,是因为溶液中的A13+离子能与铜锈反应
D.肾功能衰竭等疾病引起的血液中毒,可利用血液透析进行治疗,该过程涉及胶体性质的应用
查看答案和解析>>
科目:高中化学 来源: 题型:
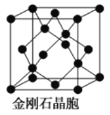
【题目】下面是一些晶体的结构示意图。请回答下列问题:
(1)下图为金刚石晶胞,则1个金刚石晶胞含有_________个碳原子。若碳原子半径为r,金刚石晶胞的边长为a,根据硬球接触模型,则r=_________a。
(2)下图为钛酸钡晶体的晶胞结构,该晶体经X—射线分析得出,重复单位为立方体,顶点位置被Ti4+所占据,体心位置被Ba2+所占据,棱心位置被O2-所占据。
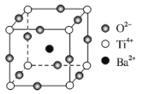
①在该物质的晶体中,每个Ti4+周围与它距离最近且相等的Ti4+有_____个,它们的空间构型为_____。O2-的钡配位数是______。
②若将Ti4+置于晶胞的体心,Ba2+置于晶胞顶点,则O2-处于立方体的______位置。
(3)PbS是一种重要的半导体材料,具有NaCl型结构(如下图),其中阴离子采用面心立方最密堆积方式,X—射线衍射实验测得PbS的晶胞参数为a=0.594nm。

①已知坐标参数:A(0,0,0),B(![]() ,
,![]() ,0),则C 的坐标参数为 ________ 。
,0),则C 的坐标参数为 ________ 。
②PbS晶体的密度为______ gcm-3。(列出计算式即可)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏伽德罗常数的值。关于常温下pH=2的H2SO4溶液,溶液中不存在H2SO4分子,但存在HSO4一离子,下列说法错误的是
A.每升溶液中的H+数目为0.01NA
B.Na2SO4溶液中:c(Na+)=2c(SO42-)>c(H+)=2c(OH-)
C.向稀硫酸中逐滴滴加浓硫酸,溶液中![]() 减小
减小
D.NaHSO4不是弱电解质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以镍黄铁矿为原料制备![]() 的工艺流程如下:
的工艺流程如下:
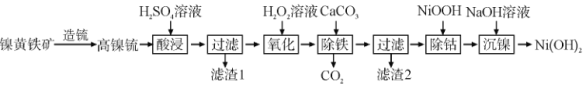
已知:①高镍锍的主要成分为![]() 、
、![]() 、
、![]() 、
、![]() 的低价硫化物及合金;
的低价硫化物及合金;
②氧化性:![]() ;
;
③![]() ,
,![]() ,
,![]() 。
。
回答下列问题:
(1)“酸浸”时,![]() 溶液需过量,其目的是________。
溶液需过量,其目的是________。
(2)“氧化”时反应的化学方程式为________,若用![]() 代替
代替![]() 溶液,使
溶液,使![]() 转化为
转化为![]() ,则需
,则需![]() 至少为________
至少为________![]() 。
。
(3)“除铁”的原理是________。
(4)“过滤”时滤渣1的主要成分是________。
(5)“沉镍”后需过滤、洗涤,证明沉淀已洗涤干净的方法是________________。若“沉镍”后的滤液中![]() ,则滤液的
,则滤液的![]() ________。
________。
(6)“除钴”时,发生反应的离子方程式为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com