
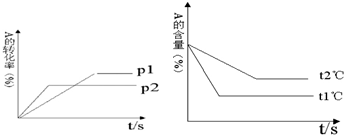


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、MgCO3易溶于水 |
| B、硅单质常用作半导体材料、光导纤维和太阳能电池 |
| C、铜与硫在加热条件下生成Cu2S |
| D、Na2SiO3溶液通常保存在带玻璃塞的磨口试剂瓶中 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 实验目的 | 玻璃仪器 |
| A | 实验室用浓氨水与生石灰制备并收集NH3 | 普通漏斗、烧杯、玻璃棒 |
| B | 用1mol?L-1NaOH溶液配制96mL0.1mol?L-1NaOH溶液 | 100mL容量瓶、烧杯、胶头滴管、玻璃棒、量筒 |
| C | 用溴乙烷与硝酸银溶液制备且分离出溴化银 | 胶头滴管、试管 |
| D | 用浓硫酸与乙醇制备并收集乙烯 | 圆底烧瓶、酒精灯、导管、集气瓶 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、苯、汽油和植物油都是碳氢化合物 |
| B、甲烷、乙醇、乙酸、乙酸乙酯都能发生取代反应和氧化反应 |
| C、水电站把机械能转化成电能,而核电站是把化学能转化成电能 |
| D、糖类、油脂、蛋白质都是高分子化合物,都能发生水解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
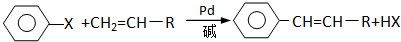 (X为卤原子,R为取代基)
(X为卤原子,R为取代基)
查看答案和解析>>
科目:高中化学 来源: 题型:
| 放电 |
| 充电 |
| A、需要定期补充硫酸 | ||
| B、放电时电解质的密度减小 | ||
| C、放电时铅是负极,PbO2是正极 | ||
D、放电时负极上发生的反应是Pb+S
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验编号 | HA物质的量浓度(mol/L) | NaOH物质的量浓度(mol/L) | 混合溶液的pH |
| ① | 0.1 | 0.1 | pH=9 |
| ② | c | 0.2 | pH=7 |
| ③ | 0.2 | 0.1 | pH<7 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NaA>NaC>NaD |
| B、NaC>NaA>NaD |
| C、NaD>NaA>NaC |
| D、NaC>NaD>NaA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com