
一定条件下,通过下列反应可以制备特种陶瓷的原料MgO:
MgSO4(s)+CO(g) MgO(s)+CO2(g)+SO2(g) ΔH>0
MgO(s)+CO2(g)+SO2(g) ΔH>0
该反应在恒容的密闭容器中达到平衡后,若仅改变图中横坐
标x的值,重新达到平衡后,纵坐标y随x变化趋势合理的
是
| 选项 | x | y |
| A | MgSO4的质量(忽略体积) | CO的转化率 |
| B | CO的物质的量 | CO2与CO的物质的量之比 |
| C | SO2的浓度 | 平衡常数K |
| D | 温度 | 容器内混合气体的密度 |
 名校作业本系列答案
名校作业本系列答案 轻巧夺冠周测月考直通名校系列答案
轻巧夺冠周测月考直通名校系列答案科目:高中化学 来源: 题型:
中华人民共和国国家标准(CB2760-2011)规定葡萄酒中SO2最大使用量为0.25 g·L-1。某兴趣小组用图(a)装置(夹持装置略)收集某葡萄酒中的SO2,并对其含量进行测定。
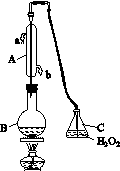
(a)
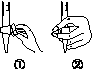
(b)
(1)仪器A的名称是__________________,水通入A的进口为________。
(2)B中加入300.00 mL葡萄酒和适量盐酸,加热使SO2全部逸出并与C中的H2O2完全反应,其化学方程式为________________________。
(3)除去C中过量的H2O2,然后用0.090 0 mol·L-1NaOH标准溶液进行滴定,滴定前排气泡时,应选择图(b)中的________;若滴定终点时溶液的pH=8.8,则选择的指示剂为________;若用50 mL滴定管进行实验,当滴定管中的液面在刻度“10”处,则管内液体的体积(填序号)________(①=10 mL,②=40 mL,③<10 mL,④>40 mL)。
(4)滴定至终点时,消耗NaOH溶液25.00 mL,该葡萄酒中SO2含量为________ g·L-1。
(5)该测定结果比实际值偏高,分析原因并利用现有装置提出改进措施:________________________________________________________________________
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)向MnSO4和硫酸的混合溶液里加入K2S208(过二硫酸钾),溶液中会发生如下反应:Mn2++ S2082-+H2O→MnO4-+SO42一十H+该反应常用于检验Mn2+的存在。其特征现象是 。
若反应中有0.1 mol还原剂参加反应,则消耗氧化剂的物质的量为 mol。
(2)若该反应所用的硫酸锰改为氯化锰,当它跟过量的过硫酸钾反应时,除有高锰酸钾、硫酸钾、硫酸生成外,其他的生成物还有 。
(3)将NaBiO3固体(黄色微溶)加入到MnSO3和H2S04的混合溶液里加热,固体溶解变为澄清溶液,发生如下反应:
NaBi03+ MnSO4+ H2S04→ Na2S04+ Bi2(S04)3+ NaMnO4+ H2O
①配平上述反应的化学方程式;
②上述反应中还原产物是 。
③用单线桥表示该氧化还原反应
(4)S2O82-在一定条件下,可转变为S2O32-,写出往K2S2O3中滴加稀硫酸的离子方程式:
查看答案和解析>>
科目:高中化学 来源: 题型:
pH相同的氨水和NaOH溶液,分别用蒸馏水稀释至原体积的m倍和n倍,稀释后两
溶液的pH仍然相同,则m和n的关系是
A.m<n B.m=n C.m>n D.不能确定
查看答案和解析>>
科目:高中化学 来源: 题型:
X、Y、Z三种气体,把a mol X与b mol Y充入一密闭容器中,发生反应:
X+2Y 2Z。达到平衡时,若它们的物质的量满足:n(X)+n(Y)=n(Z),则Y的转
2Z。达到平衡时,若它们的物质的量满足:n(X)+n(Y)=n(Z),则Y的转
化率为 
A.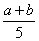 ×100% B.
×100% B.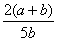 ×100%
×100%
C. ×100% D.
×100% D.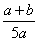 ×100%
×100%
查看答案和解析>>
科目:高中化学 来源: 题型:
降低大气中CO2的含量及有效利用CO2,目前已引起各国普遍重视。
(1)工业上有一种方法是用CO2来生产燃料甲醇。为探究反应原理,现进行如下实
验,在体积为1 L的密闭容器中,充入1 mol CO2和3 mol H2,在500℃下发生
反应:CO2(g)+3H2(g) 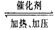 CH3OH(g)+H2O(g) 。
CH3OH(g)+H2O(g) 。
实验测得CO2(g)和CH3OH(g)的浓度随时间变化如下图1所示。
①图2是改变温度时H2的化学反应速率随时间变化的示意图,则该反应的正反
应是 (填“吸热”或“放热”)反应。
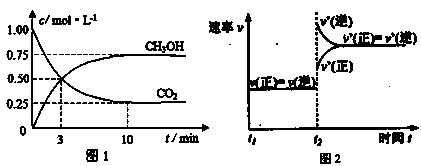
②500℃达平衡时,CH3OH的体积分数为 。
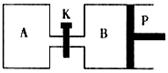 (2)右图中P是可自由平行滑动的活塞,关闭K,在
(2)右图中P是可自由平行滑动的活塞,关闭K,在
相同温度时,向A容器中充入
1molCH3OH(g)和2molH2O(g),向B容器中充入
1.2molCH3OH(g) 和2.4molH2O(g),两容器分别发生上述(1)中反应的逆反应。
已知:起始时容器A和B的体积均为aL,反应达到平衡时容器B的体积为1.5aL,
容器B中CH3OH转化率为 ;维持其他条件不变,若打开K一段时
间后重新达到平衡,容器B的体积为 L(连通管中气体体积忽略不计,
且不考虑温度的影响)。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是(NA表示阿伏加德罗常数的值)( )。
A.摩尔是七个基本物理量之一
B.阿伏加德罗常数就是6.02×1023 mol-1
C.1mol氢的质量是2 g
D.1mol甲烷的质量与NA个甲烷分子的质量之和相等
查看答案和解析>>
科目:高中化学 来源: 题型:
硫酸亚铁(FeSO4·7H2O)是一种重要的食品和饲料添加剂。实验室通过如下实验由废铁屑制备FeSO4·7H2O晶体:
① 将5%Na2CO3溶液加入到盛有一定量废铁 屑的烧杯中,加热数分钟,用倾析法除去Na2CO3溶液,然后将废铁屑用水洗涤2至3遍;
屑的烧杯中,加热数分钟,用倾析法除去Na2CO3溶液,然后将废铁屑用水洗涤2至3遍;
② 向洗涤过的废铁屑中加入过量的稀硫酸,控制温度在50-80℃之间至铁屑耗尽;
③ 趁热过滤,将滤液转入到密闭容器中,静置、冷却结晶;
④ 待结晶完毕后,滤出晶体,用少量冰水洗涤2-3次,再用滤纸将晶体吸干;
⑤ 将制得的FeSO4·7H2O晶体放在一个小广口瓶中,密闭保存。
请回答下列问题:
⑴ 实验步骤①的目的是____________________,加热的作用是__________________。
⑵ 实验步骤②明显不合理,理由是_______________________________。
⑶ 实验步骤④中用少量冰水洗涤晶体,其目的是______________;______________。
⑷ 经查阅资料后发现,硫酸亚铁在不同温度下结晶可分别得到FeSO4·7H2O、FeSO4·4H2O、和FeSO4·H2O。硫酸亚铁在不同温度下的溶解度和该温度下析出晶体的组成如下表所示(仅在56.7℃、64℃温度下可同时析出两种晶体)。
硫酸亚铁的溶解度和析出晶体的组成
| 温度/℃ | 0 | 10 | 30 | 50 | 56.7 | 60 | 64 | 70 | 80 | 90 | ||
| 溶解 度/g | 14.0 | 17.0 | 25.0 | 33.0 | 35.2 | 35.3 | 35.6 | 33.0 | 30.5 | 27 | ||
| 析出晶体 | FeSO4·7H2O | FeSO4·4H2O | FeSO4·H2O | |||||||||
请根据表中数据作出硫酸亚铁的溶解度曲线。
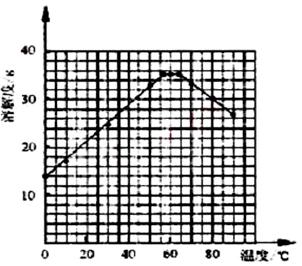
⑸ 若需从硫酸亚铁溶液中结晶出FeSO4·4H2O,应控制的结晶温度(t)的范围为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
为测定镀锌铁皮锌镀层的厚度,将镀锌皮与足量盐酸反应,待产生的气泡明显减少时取出,洗涤,烘干,称重。关于该实验的操作对测定结果的影响判断正确的是
A.铁皮未及时取出,会导致测定结果偏小
B.铁皮未洗涤干净,会导致测定结果偏大
C.烘干时间过长,回导致测定结果偏小
D.若把盐酸换成硫酸,会导致测定结果偏大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com