
����˵����ȷ����
A��CH4(g) + 3/2O2(g) == CO(g) +2H2O(l) ��H== ��a kJ��mol��1 �����捻H����ȼ����
B����250C��101kPa��1mol���2mol���ȼ�������
C��CO�Dz��ȶ�����������ܼ�����������Ӧ�����ȶ���CO2������CO��ȼ�շ�Ӧһ�������ȷ�Ӧ
D��101kPaʱ��1mol̼ȼ�����ų�������Ϊ̼��ȼ����

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
���ࡢ֬���͵�������ά����������������������Ӫ�����ʡ�����������ȷ����
A��ֲ���Ͳ���ʹ��ˮ��
B������ˮ������ղ�����������
C���������ܷ���������Ӧ��ˮ�ⷴӦ
D����������Һ������ͭ������ij�������������ˮ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�����ƶ���ȷ����
A��SO2��CO2�������������������NaOH��Һ��Ӧ
B��Na2O��Na2O2���Ԫ����ͬ����CO2��Ӧ����Ҳ��ȫ��ͬ
C��NO��NO2���ܶȶ��ȿ����������������ſ������ռ�
D��C3H8��CH3CH2OH��Է���������������߷е�Ҳ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����������ӷ���ʽ
��1����ʳ�����ˮ������Ҫ�ɷ���CaCO3����
��2����������������θҩ�ܽ���θ�
��3���ö��Ե缫��ⱥ���Ȼ�����Һ��
��4��������������Һ�м�����������Һ��ǡ�ó�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
δ������Դ���ص�����Դ�ḻ����ʹ��ʱ�Ի�������Ⱦ����Ⱦ��С���ҿ�����������������δ������Դ������
����Ȼ�� ��ú �ۺ��� ��ʯ�� ��̫���� ���������� �߷��� ������
A���٢ڢۢ� B���ݢޢߢ�
C���ۢݢޢߢ� D���ۢܢݢޢߢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��֪��ѧ��Ӧ2C(s)+O2(g) 2CO(g)��2CO(g) + O2(g)
2CO(g)��2CO(g) + O2(g)  2CO2(g)���Ƿ��ȷ�Ӧ���ݴ��ƶϣ�����˵������ȷ���ǣ���ͬ�����£�
2CO2(g)���Ƿ��ȷ�Ӧ���ݴ��ƶϣ�����˵������ȷ���ǣ���ͬ�����£�
A��56gCO��32gO2���������������88gCO2�����������
B��28gCO�����е�����һ������12gC�����е�����
C��12gC��32gO2���������������44gCO2�����������
D�������ݵ�����̼ȼ�գ�����CO2�ķ�Ӧ������CO�ķ�Ӧ�ų���������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��36 g ̼����ȫȼ�����������У�COռ �����CO2ռ
�����CO2ռ �������
�������
C(s) + 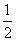 O2(g) = CO(g) ��H = ��110.5 kJ/mol
O2(g) = CO(g) ��H = ��110.5 kJ/mol
CO(g) + 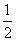 O2(g) = CO2(g) ��H = ��283 kJ/mol
O2(g) = CO2(g) ��H = ��283 kJ/mol
����Щ̼��ȫȼ����ȣ���ʧ��������
A��172.5 kJ B�� 1149 kJ C��283kJ D�� 517.5 kJ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�����й����ӷ���ʽ��д��ȷ��
A.��ǿ����Һ�д���������Fe(0H)3��Ӧ����Na2FeO4
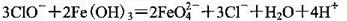
B�����ữ�ĺ����ҽ���Һ����ȡ�⣺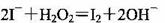
C���Խ�����Ϊ������ⱥ������ͭ��Һ��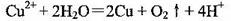
D������������ʹ����KMnO4��Һ��ɫ��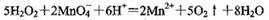
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��Na2SO4��������0.2 mol/L Na2SO4��Һ50mL��
��1����Ҫ�IJ���������50 mL����ƿ���ձ�����Ͳ���������� ��
��2����������ƽ����Na2SO4���������Ϊ ��
��3�����в�����ʵ�����к�Ӱ�죨�ƫ�ߡ�����ƫ�͡�������Ӱ�족��
A�����ձ��е���Һע������ƿ��δϴ���ձ���
B������ʱ��������ƿ�Ŀ̶��ߡ�
C��ѡ�õ�����ƿ�ڲ�������������ˮ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com