
【题目】实验室用硫酸亚铁铵[(NH4)2Fe(SO4)2·6H2O]滴定法测定铬铁矿中铬含量的过程如下:
酸溶:准确称取0.1950 g铬铁矿试样放入锥形瓶中,加入适量磷酸和硫酸的混合酸,加热使试样完全溶解,冷却。
氧化:向上述溶液中滴加5滴1%的MnSO4溶液,再加入一定量的过硫酸铵[(NH4)2S2O8]溶液,摇匀,加热煮沸至出现紫红色,继续加热煮沸至紫红色褪去,冷却。[已知:①2Mn2+ + 5S2O82- + 8H2O = 10SO42- + 2MnO4- + 16H+;②继续加热煮沸后,溶液中过量(NH4)2S2O8和生成的HMnO4已分解除去]
滴定:用0.2050mol·L-1(NH4)2Fe(SO4)2标准溶液滴定上述溶液至终点,消耗19.50 mL标准溶液。(已知:Cr2O72-![]() Cr3+)
Cr3+)
(1)过硫酸铵保存在棕色试剂瓶中的原因是___________。
(2)①“氧化”的目的是将试样溶液中的Cr3+氧化成Cr2O72-,加入5滴MnSO4溶液的目的是________________(已知该条件下还原性:Cr3+ > Mn2+)。
②“氧化”过程中,如果继续加热煮沸时间不充足,会使铬含量的测定结果______(填“偏大”“不变”或“偏小”)。
(3)计算铬铁矿中铬的质量分数(写出计算过程)。___________
【答案】过硫酸铵见光易分解 判断溶液中的Cr3+是否完全被氧化成Cr2O72-[或作为Cr3+与(NH4)2S2O8反应的指示剂] 偏大 35.53%
【解析】
(1)棕色试剂瓶是存放见光易分解的物质;
(2)①加入5滴MnSO4溶液的目的是作为Cr3+与(NH4)2S2O8反应的指示剂;
②“氧化”过程中,如果继续加热煮沸时间不充足,溶液中过量的(NH4)2S2O8和生成的HMnO4不能完全分解除去,会消耗更多(NH4)2Fe(SO4)2标准溶液;
(3)6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O,得到:6Fe2+~Cr2O72-,结合操作过程中的定量关系计算。
(1)过硫酸铵保存在棕色试剂瓶中的原因是:过硫酸铵见光易分解,
故答案为:过硫酸铵见光易分解;
(2)①“氧化”的目的是将试样溶液中的Cr3+氧化成Cr2O72,加入5滴MnSO4溶液的目的是:作为Cr3+与(NH4)2S2O8反应的指示剂,判断溶液中的Cr3+是否完全被氧化成Cr2O72,
故答案为:判断溶液中的Cr3+是否完全被氧化成Cr2O72;
②“氧化”过程中,如果继续加热煮沸时间不充足,溶液中过量的(NH4)2S2O8和生成的HMnO4不能完全分解除去,会消耗更多(NH4)2Fe(SO4)2标准溶液,导致计算得到结果偏大,
故答案为:偏大;
(3)6Fe2++ Cr2O72+14H+=6Fe3++2Cr3++7H2O,
得到:6Fe2+Cr2O72,
n(Cr2O72)=16×0.2050molL1×19.50mL×103mLL1=6.6625×104mol,
铬的质量分数=![]() ×100%=35.53%,
×100%=35.53%,
故答案为:35.53%。


科目:高中化学 来源: 题型:
【题目】25℃时,进行下图所示滴定并得到对应曲线。下列说法错误的是( )
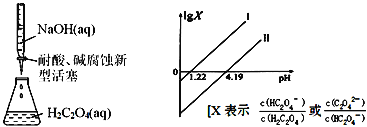
A.Ka2(H2C2O4)=10-4.19
B.直线Ⅰ中X=![]()
C.在NaHC2O4溶液中c(H2C2O4)+c(H+)=c(OH-)+c(C2O42-)
D.Ⅰ、Ⅱ两条直线的斜率均为1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究NO2、SO2 、CO等大气污染气体的处理具有重要意义。
(1)一定条件下,将2molNO与2molO2置于恒容密闭容器中发生如下反应:2NO(g)+O2(g)![]() 2NO2(g),下列各项能说明反应达到平衡状态的是_____________。
2NO2(g),下列各项能说明反应达到平衡状态的是_____________。
A.体系压强保持不变
B.混合气体颜色保持不变
C.NO和O2的物质的量之比保持不变
D.每消耗1 molO2同时生成2 molNO
(2)CO可用于合成甲醇,一定温度下,向体积为2L的密闭容器中加入CO和H2,发生反应CO(g)+2H2(g)![]() CH3OH(g),达平衡后测得各组分浓度:
CH3OH(g),达平衡后测得各组分浓度:
物质 | CO | H2 | CH3OH |
浓度(mol/L) | 0.9 | 1.0 | 0.6 |
回答下列问题:
①混合气体的平均相对分子质量=_________________。
②平衡常数K=__________________。
③若将容器体积压缩为1L,不经计算,预测新平衡中c(H2)的取值范围是__________。
④若保持体积不变,再充入0.6molCO和0.4molCH3OH,此时v正______v逆(填“>”、“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在氯碱工业中,离子交换膜法电解饱和食盐水示意图如下,下列说法不正确的是( )
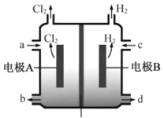
离子交换膜
A.电极A为阳极,发生氧化反应生成氯气
B.离子交换膜为阳离子交换膜
C.饱和NaCl从a处进,NaOH溶液从d处出
D.OH-迁移的数量等于导线上通过电子的数量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定量的密闭容器中,充入浓度分别为0.20mol·L-1、0.10mol·L-1 SO2和O2,发生反应:2SO2(g)+O2(g)2SO3(g)。当反应达到平衡时,不可能存在的数据是
A.SO2为0.10 mol·L-1B.O2为0.05mol·L-1
C.SO2为0 mol·L-1D.SO3为0.15 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,向![]() 盐酸中滴加
盐酸中滴加![]() 溶液,溶液的pH随
溶液,溶液的pH随![]() 溶液体积的变化如图。已知
溶液体积的变化如图。已知![]() 。下列说法不正确的是( )
。下列说法不正确的是( )
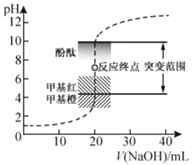
A.![]() 与盐酸恰好完全反应时,
与盐酸恰好完全反应时,![]()
B.选择变色范围在pH突变范围内的指示剂,可减小实验误差
C.选择甲基红指示反应终点,误差比甲基橙的大
D.![]() 时,
时,![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有一定量含有Na2O杂质的Na2O2试样,用如图的实验装置测定Na2O2试样的纯度。
回答下列问题:

(1)装置A中盛放稀盐酸的仪器名称为__________________。
(2)装置B的作用是______________________________________。
(3)装置C的作用是____________________________________________。
(4)装置D中发生反应的化学方程式是_____________、_______________。
(5)装置E中碱石灰的作用是______________________________________。
(6)若开始时称得样品的质量为4.52 g,反应结束后称得固体的质量为6.36g,则Na2O2试样的纯度为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数的值,下列说法错误的是( )
A. 4.6g由NO2和N2O4组成的混合气体中含有的原子总数为0.3NA
B. 0.2gD216O中含有的质子数,中子数,电子数均为0.1NA
C. 6.2克白磷分子(P4)中含P—P键为0.05NA
D. 铁与足量稀硝酸反应时,生产0.1molNO转移的电子数为0.3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】大力发展电动汽车,可以有效控制空气污染.目前机动车常使用的电池有铅蓄电池、锂电池等.
Ⅰ![]() 铅蓄电池充放电的总反应为:
铅蓄电池充放电的总反应为:![]()
![]()
![]() ,锂硫电池充放电的总反应为:
,锂硫电池充放电的总反应为:![]()
![]()
![]() .
.
![]() 放电时,铅蓄电池的负极反应式为 ______ .
放电时,铅蓄电池的负极反应式为 ______ .
![]() 锂硫电池工作时,电子经外电路流向 ______
锂硫电池工作时,电子经外电路流向 ______ ![]() 填“正极”或“负极”
填“正极”或“负极”![]() .
.
![]() 当消耗相同质量的负极活性物质时,锂硫电池的理论放电量是铅蓄电池的 ______ 倍.
当消耗相同质量的负极活性物质时,锂硫电池的理论放电量是铅蓄电池的 ______ 倍.
Ⅱ![]() 由方铅矿
由方铅矿![]() 制备铅蓄电池电极材料
制备铅蓄电池电极材料![]() 的方法如下:
的方法如下:
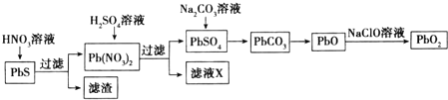
![]() 油画所用的白色颜料
油画所用的白色颜料![]() 置于空气中,遇
置于空气中,遇![]() 气体变成黑色PbS,从而使油画的色彩变暗,用
气体变成黑色PbS,从而使油画的色彩变暗,用![]() 清洗,可使油画“复原”.
清洗,可使油画“复原”.
![]() 的作用是 ______.
的作用是 ______.
![]() 已知硫化铅溶于水时存在溶解平衡:
已知硫化铅溶于水时存在溶解平衡:![]() ,试分析
,试分析![]() 能溶于稀
能溶于稀![]() 的原因 ______.
的原因 ______.
![]() 滤液X是一种可循环使用的物质,其溶质主要是 ____
滤液X是一种可循环使用的物质,其溶质主要是 ____ ![]() 填化学式
填化学式![]() ,若X中残留的
,若X中残留的![]() 过多,循环使用时可能出现的问题是 ____.
过多,循环使用时可能出现的问题是 ____.
![]() 与次氯酸钠溶液反应可制得
与次氯酸钠溶液反应可制得![]() ,写出该反应的离子方程式 ______ .
,写出该反应的离子方程式 ______ .
![]() 以石墨为电极,电解
以石墨为电极,电解![]() 溶液也可以制得
溶液也可以制得![]() ,则阳极的电极反应式为 ______ ;电解时为提高Pb元素的利用率,常在
,则阳极的电极反应式为 ______ ;电解时为提高Pb元素的利用率,常在![]() 溶液中加入适量
溶液中加入适量![]() ,理由是 ______ .
,理由是 ______ .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com