
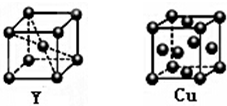
 X、Y、Z、R为前四周期元素,X为地壳中含量最多的金属元素,Y元素的焰色反应为黄色,Z是海水中除氢、氧元素外含量最多的元素,其单质或化合物也是自来水生产过程中常用的消毒杀菌剂,R基态原子3d轨道的电子数是4s轨道电子数的3倍.
X、Y、Z、R为前四周期元素,X为地壳中含量最多的金属元素,Y元素的焰色反应为黄色,Z是海水中除氢、氧元素外含量最多的元素,其单质或化合物也是自来水生产过程中常用的消毒杀菌剂,R基态原子3d轨道的电子数是4s轨道电子数的3倍.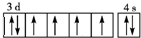 ,常用NH4SCN溶液检验Fe3+,溶液变成血红色;
,常用NH4SCN溶液检验Fe3+,溶液变成血红色; ;B;
;B;

 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案科目:高中化学 来源: 题型:
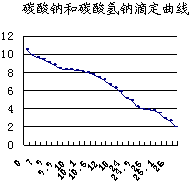 (1)滴定法是中学化学一种常见的实验方法,其根据指示剂的颜色变化指示滴定终点,然后目测标准溶液消耗体积,计算分析结果.常用的指示剂有酚酞(变色范围8.2~10.0)和甲基橙(变色范围3.1~4.4).如图为碳酸钠和碳酸氢钠混合溶液滴定曲线(横坐标为加入HCl的量,纵坐标为pH的变化),现以0.1000mol?L-1的盐酸来测定amL某浓度碳酸钠溶液的浓度,可以选用
(1)滴定法是中学化学一种常见的实验方法,其根据指示剂的颜色变化指示滴定终点,然后目测标准溶液消耗体积,计算分析结果.常用的指示剂有酚酞(变色范围8.2~10.0)和甲基橙(变色范围3.1~4.4).如图为碳酸钠和碳酸氢钠混合溶液滴定曲线(横坐标为加入HCl的量,纵坐标为pH的变化),现以0.1000mol?L-1的盐酸来测定amL某浓度碳酸钠溶液的浓度,可以选用| 实验步骤 | 结果分析 |
| 步骤1:取少量样品于试管中,加入适量蒸馏水使之溶解, | 有白色沉淀生成,说明产品中含有NaCl. |
| 步骤2:另取少量样品于锥形瓶中,加入适量蒸馏水使之溶解,加入几滴酚酞,用0.1000mol?L-1盐酸滴定至溶液由红色变无色,记录消耗盐酸的体积V1. | 说明产品中含有NaHCO3. |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、钠原子有强还原性,钠离子有弱氧化性 |
| B、若电解熔融的氯化钠,则钠离子被氧化成钠原子 |
| C、钠很活泼,在一定条件下可以置换出金属活动性顺序表钠后面的金属 |
| D、钠是电和热的良导体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、能用丁达尔效应鉴别 |
| B、都是电解质 |
| C、将NaOH溶液加入FeCl3溶液中有红褐色沉淀生成,加入Fe(OH)3胶体则没有沉淀 |
| D、能用过滤的方法分离 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、金属氧化物都是强电解质 |
| B、一种元素可能有多种氧化物,但同种化合价只对应一种氧化物 |
| C、在化学反应中,一定有化学键的断裂和形成,并伴有能量的变化 |
| D、能与金属镁反应产生氢气的溶液一定是酸溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
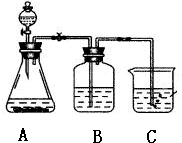 某学习小组同学为了确定盐酸、苯酚、碳酸的酸性强弱,设计了如图所示的装置图进行实验:
某学习小组同学为了确定盐酸、苯酚、碳酸的酸性强弱,设计了如图所示的装置图进行实验:查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com