
下列有关电解质溶液的说法正确的是
| A.在蒸馏水中滴加浓H2SO4,KW不变 |
| B.CaCO3难溶于稀硫酸,也难溶于醋酸 |
| C.在Na2S稀溶液中,c(H+)=c(OH-)-2c(H2S)-c(HS-) |
| D.NaCl溶液和CH3COONH4溶液均显中性,两溶液中水的电离程度相同 |
 优生乐园系列答案
优生乐园系列答案科目:高中化学 来源: 题型:单选题
醋酸溶液中存在电离平衡CH3COOH H++CH3COO-,下列叙述不正确的是( )
H++CH3COO-,下列叙述不正确的是( )
| A.醋酸溶液中离子浓度的关系满足:c(H+)=c(OH-)+c(CH3COO-) |
| B.0.10mol/L的CH3COOH溶液中加水稀释,溶液中c(OH-)减小 |
| C.CH3COOH溶液中加少量的CH3COONa固体,平衡逆向移动 |
| D.常温下pH=2的CH3COOH溶液与pH=12的NaOH溶液等体积混合后,溶液的pH<7 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列说法不正确的是
| A.NaHCO3和Na2CO3混合溶液中:c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-) |
| B.常温下,浓度均为0.1 mol·L-1下列各溶液的pH:NaOH>Na2CO3> NaHCO3> NH4Cl |
| C.向冰醋酸中逐滴加水,醋酸的电离程度、pH均先增大后减小 |
| D.常温下,pH=1的稀硫酸与醋酸溶液中,c(SO42-)与c(CH3COO-)之比为2∶1 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
常温下现有的四份溶液:
①0.01 mol/L HCl;②0.01 mol/L CH3COOH;③pH=12 的氨水;④pH=12的NaOH溶液。
下列说法正确的是
| A.②中由水电离出的c(H+)=1×10-12mol/L |
| B.将①、③混合,若有pH=7,则消耗溶液的体积:③>① |
| C.将②、④等体积混合(体积变化忽略不计),则c(CH3COO-)+c(CH3COOH)=0.01 mol/L |
| D.将四份溶液均稀释10倍后溶液pH:③>④,②<① |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
室温下,向10 mL 0.1 mol/L醋酸溶液中加水稀释后,下列说法正确的是( )
| A.溶液中粒子的数目减小 |
| B.再加入CH3COONa固体能促进醋酸的电离 |
| C.醋酸的电离程度增大,c(H+)亦增大 |
D.溶液中 不变 不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
不同温度下,水溶液中c(H+)与c(OH-)的关系如图所示。下列有关说法中正确的是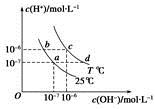
| A.若从a点到c点,可采用在水中加入酸的方法 |
| B.b点对应的醋酸中由水电离的c(H+)=10-6mol·L-1 |
| C.c点对应溶液的Kw大于d点对应溶液的Kw |
| D.T℃时,0.05 mol·L-1的Ba(OH)2溶液的pH=11 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
常温下,向20 mL 0.2 mol/L H2A溶液中滴加0.2 mol/L NaOH溶液。有关粒子的物质的量变化如图(其中Ⅰ代表H2A,Ⅱ代表HA-,Ⅲ代表A2-),根据图示判断,下列说法正确的是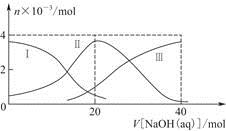
| A.当V[NaOH(aq)]=20 mL时,溶液中离子浓度大小关系: c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-) |
| B.等体积等浓度的NaOH溶液与H2A溶液混合后,其溶液中水的电离程度比纯水大 |
| C.H2A第一步电离的方程式为H2A=HA-+H+ |
| D.向NaHA溶液加入水稀释的过程中,pH可能增大也可能减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
常温下,几种难溶电解质的溶度积和弱酸的电离常数如下表所示: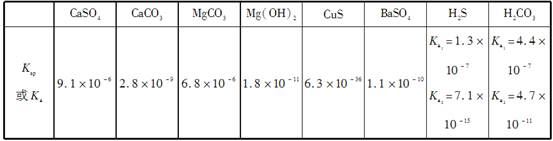
则下列说法不正确的是
| A.相同温度、相同浓度的钠盐溶液的pH:Na2S>Na2CO3>NaHS>NaCl>NaHSO4 |
| B.在NaHS溶液中滴加硫酸铜溶液,生成黑色沉淀:HS-+Cu2+=CuS↓+H+ |
| C.除去锅炉中的水垢时,通常先加入足量硫酸钠溶液,将碳酸钙转化成硫酸钙,然后再用酸液处理 |
D.在Mg(HCO3)2溶液中滴加澄清石灰水发生反应的离子方程式为Mg2++2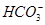 +2Ca2++4OH-=Mg(OH)2↓+2CaCO3↓+2H2O +2Ca2++4OH-=Mg(OH)2↓+2CaCO3↓+2H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com