
【题目】某稀硫酸和稀硝酸的混合溶液200mL,平均分成两份。向其中一份中逐渐加入铜粉,最多能溶解9.6g。向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如下图所示(己知硝酸只被还原为NO气体)。下列分析或结果错误的是
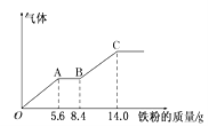
A.H2SO4浓度为2.5mol·L-1
B.OA段产生的是NO,AB段的反应为Fe+2Fe3+=3Fe2+,BC段产生氢气
C.第二份溶液中最终溶质为FeSO4
D.原混合酸中NO3-的物质的量为0.1mol
【答案】D
【解析】
试题分析:A、根据图像可知,加入14.0g铁粉时,气体不再增加,说明反应完全,生成硫酸亚铁的物质的量是14.0g/56g/mol=0.25mol,所以硫酸的物质的量浓度为0.25mol/0.1L=2.5mol/L,A正确;B、在稀硝酸与稀硫酸的混合液中,加入铁粉,铁先与硝酸发生氧化还原反应,所以OA段产生是NO,硝酸根全部消耗完后,再加铁粉,由于铁离子的氧化性大于氢离子,此时AB段气体的量不变,所以此时发生的反应2Fe3++Fe=3Fe2+,继续加入铁粉,则铁粉与氢离子反应生成氢气,B正确;C、硝酸根全部被还原为NO,所以最终的溶液是硫酸亚铁溶液,C正确;D、铜与混酸反应的离子方程式为3Cu+2NO3-+8H+=3Cu2++2NO↑+4 H2O,铜粉最多溶解9.6g,物质的量是9.6g/64g/mol=0.15mol,则硝酸全部做氧化剂,需要硝酸根离子的物质的量是0.1mol,所以原混合液中NO3-的物质的量为0.2mol,D错误;答案选D。


科目:高中化学 来源: 题型:
【题目】下列实验误差分析不正确的是
A. 用润湿的pH试纸测稀碱溶液的pH,测定值偏小
B. 用沾有水珠的锥形瓶盛装待测液进行滴定,测定浓度偏小
C. 滴定前滴定管内无气泡,终点读数时有气泡,读取数值偏小
D. 测定中和反应的反应热时,将碱缓慢倒入酸中,所测温度值偏小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A.0.012kg12C所含的碳原子数就是阿伏伽德罗常数
B.等质量的O2和O3中所含氧原子的物质的量相同
C.等物质的量的分子所含原子数目一定相等
D.标准状况下,1molH2的体积约为22.4L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(一)以下反应:①木炭与水制备水煤气 ②氯酸钾分解 ③炸药爆炸 ④酸与碱的中和反应 ⑤生石灰与水作用制熟石灰 ⑥ Ba(OH)2·8H2O与NH4Cl,属于放热反应的是 (填序号),写出反应⑥的化学方程式__ 。
(二)为了合理利用化学能,确保安全生产,化工设计需要充分考虑化学反应的焓变,并采取相应措施.化学反应的焓变通常用实验进行测定,也可进行理论推算。
(1)丙烯是石化工业的主要原料之一,由于市场对丙烯的需求量激增,丙烷脱氢制丙烯的技术日益受到重视。某研究机构需得到C3H8(g)===3C(石墨,s)+4H2(g)的ΔH,但直接测定实验难进行,可通过下图中各组物质能量总和及相互间转化中的能量变化计算得到:

①判断:ΔH________0(选填“>”、“<”或“=”)。
②ΔH=___________(用含ΔH1、ΔH2、ΔH3的代数式表示)。
(2)实验测得,5g甲醇在氧气中充分燃烧生成二氧化碳气体和液态水时释放出113.5kJ的热量,试写出甲醇燃烧的热化学方程式:_________________。
(3)由气态基态原子形成1mol化学键释放的最低能量叫键能.从化学键的角度分析,化学反应的过程就是反应物的化学键的断裂和生成物的化学键的形成过程.在化学反应过程中,拆开化学键需要消耗能量,形成化学键又会释放能量.已知反应N2(g)+3H2(g)![]() 2NH3(g) △H=a kJ·mol-1。试根据表中所列键能数据计算a的数值: (写出 + 或-)。[
2NH3(g) △H=a kJ·mol-1。试根据表中所列键能数据计算a的数值: (写出 + 或-)。[
化学键 | H-H | N-H | N≡N |
键能/kJ·mol-1 | 436 | 391 | 945 |
(4)依据盖斯定律可以对某些难以通过实验直接测定的化学反应的反应热进行推算。
已知:C(石墨,s)+O2(g)=CO2(g) △H1=-393.5kJ·mol-1
2H2(g)+O2(g)=2H2O(l) △H2=-571.6kJ·mol-1
2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l) △H3=-2599kJ·mol-1
根据盖斯定律,计算298K时由C(石墨,s)和H2(g)生成C2H2(g)反应的反应的热化学方程式: _ _ _。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,某容积固定的密闭容器由可移动的活塞隔成A、B两室,分别向A、B两室充入H2、O2的混合气体和1 mol空气,此时活塞的位置如图所示。
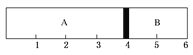
(1)A室混合气体的物质的量为________,所含分子总数为________。
(2)实验测得A室混合气体的质量为34 g,则该混合气体的密度是同温同压条件下氦气密度的________倍。
(3)若将A室H2、O2的混合气体点燃引爆,恢复原温度后,最终活塞停留的位置在________刻度,容器内气体压强与反应前气体压强之比为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化还原反应与四个基本反应类型的关系如下图所示,则下列化学反应属于阴影部分的是( )

A.Cl2+2KBr=Br2+2KCl
B.2NaHCO3![]() Na2CO3+H2O+CO2↑
Na2CO3+H2O+CO2↑
C.4Fe(OH)2+O2+2H2O=4Fe(OH)3
D.2Na2O2+2CO2=2Na2CO3+O2(提示:Na2O2中的氧为-1价)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关原电池的说法中正确的是( )
A.电极一定要由两种不同的金属组成
B.电子流出的一极是正极
C.两极均发生氧化还原反应
D.由化学能转化为电能的装置
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】N2O5是一种新型硝化剂,在一定温度下可发生以下反应:2N2O5(g)![]() 4NO2(g)+O2(g) △H>0一定温度时,向密闭容器中通入N2O5,部分实验数据见下表:
4NO2(g)+O2(g) △H>0一定温度时,向密闭容器中通入N2O5,部分实验数据见下表:
时间/s[K] | 0 | 500 | 1000 | 1500 |
c(N2O5)/mol/L | 0.50 | 0.35 | 0.25 | 0.25 |
下列说法中错误的是
A.500 s时O2的浓度为0.075 mol/L
B.平衡后,升高温度,正反应速率先增大后减小
C.平衡后,要使平衡常数增大,改变的条件是升高温度
D.1000 s时将容器的体积缩小一半,重新达到平衡时0.25 mol/L<c(N2O5)<0.50 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸和盐酸组成的混合液100.0 mL,向其中加入氢氧化钡粉末4.275g,充分反应后,经过滤、洗涤、干燥,得到沉淀2.330g,同时测得滤液中的OH-离子浓度为0.100 mol·L-1 。(设溶液总体积始终不变)请列式计算
(1)原溶液中硫酸的物质的量为____________。
(2)原混合液中盐酸的物质的量浓度_______________。
(3)若将原硫酸和盐酸混合溶液100ml与足量金属锌反应,则在标况下产生的气体体积为______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com