
【题目】下列实验误差分析不正确的是
A. 用润湿的pH试纸测稀碱溶液的pH,测定值偏小
B. 用沾有水珠的锥形瓶盛装待测液进行滴定,测定浓度偏小
C. 滴定前滴定管内无气泡,终点读数时有气泡,读取数值偏小
D. 测定中和反应的反应热时,将碱缓慢倒入酸中,所测温度值偏小
科目:高中化学 来源: 题型:
【题目】为了除去NO、NO2、N2O4对大气的污染,常采用氢氧化钠溶液进行吸收处理。反应方程式:2NO2 + 2NaOH=NaNO3 + NaNO2 + H2O;NO2 + NO + 2NaOH=2NaNO2+H2O 现有由a mol NO、b mol NO2、c mol N2O4组成的混合气体恰好被V L氢氧化钠溶液吸收(无气体剩余),则此氢氧化钠溶液的物质的量浓度为( ) mol/L
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】纯铁片与稀硫酸反应生成氢气,下列措施不能使氢气生成速率加大的是
A. 加热 B. 将稀硫酸改为浓硝酸
C. 纯铁片换成生铁片 D. 不用铁片,改用铁粉
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在某无色透明的酸性溶液中,能共存的离子组是( )
A.NH4+、NO3﹣、Al3+、Cl﹣
B.Na+、AlO2﹣、K+、NO3﹣
C.MnO4﹣、K+、SO42﹣、Na+
D.K+、SO42﹣、HCO3﹣、Na+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对阿伏伽德罗定律及推论的理解不正确的是( )
A.同温同压下,气体的体积之比等于它们的物质的量之比
B.同温同压下,气体的体积之比等于它们的质量之比
C.同温同压下,相同体积的气体质量比等于它们的相对分子质量之比
D.同温同压下,气体的密度之比等于它们的相对分子质量之比
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)K2SO4和Al2(SO4)3混合溶液中c(K+)=0.2mol·L-1,c(SO42-)=0.7mol·L-1。
①写出Al2(SO4)3的电离方程式: 。
②c(Al3+)等于 mol·L-1。
(2)粗食盐中除含有钙离子、镁离子、硫酸根离子等可溶性杂质外,还含有泥沙等不溶性杂质。我们食用的精盐是用粗盐提纯而得到的。通过教材中“粗盐的提纯”及你做过的该实验回答下列问题。
①除去Mg2+,需要加入的碱溶液为(从下列选项中选出答案,填字母,下同): ;除去SO42-,需要加入的盐溶液为: ;
A.NaOH B.KOH C.BaCl2 D.Ba(NO3)2
②经过操作①后再加入饱和Na2CO3溶液,直至不再产生沉淀为止。这步操作的目的是:除去 和 。(填写离子符号)
③将经过操作②后的悬浊液过滤,滤液中还有两种杂质。为了除去这两种杂质,最后在滤液中加入的溶液是(填溶质化学式) ;
写出除去这两种杂质发生反应的离子方程式 、 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在“绿色化学工艺”中,理想状态是反应物中的原子全部转化为欲制得的产物,即原子利用率为100%,下列反应类型能体现“绿色化学工艺”的是( )
A.化合反应
B.复分解反应
C.分解反应
D.取代反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某稀硫酸和稀硝酸的混合溶液200mL,平均分成两份。向其中一份中逐渐加入铜粉,最多能溶解9.6g。向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如下图所示(己知硝酸只被还原为NO气体)。下列分析或结果错误的是
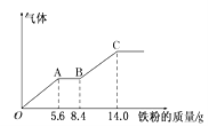
A.H2SO4浓度为2.5mol·L-1
B.OA段产生的是NO,AB段的反应为Fe+2Fe3+=3Fe2+,BC段产生氢气
C.第二份溶液中最终溶质为FeSO4
D.原混合酸中NO3-的物质的量为0.1mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com