
【题目】室温下,某二元碱X(OH)2水溶液中相关组分的物质的量分数随溶液pH变化的曲线如图所示,下列说法错误的是

A.Kb2的数量级为10-8
B.X(OH)NO3水溶液显酸性
C.等物质的量的X(NO3)2和X(OH)NO3混合溶液中 c(X2+)>c[X(OH)+]
D.在X(OH)NO3水溶液中,c[X(OH)2]+c(OH-)= c(X2+)+ c(H+)
【答案】BC
【解析】
A.根据图象,液中c[X(OH)+]=c(X2+)时,溶液pH=6.2,则溶液中c(OH-)=![]() =
=![]() =10-7.8mol/L,所以Kb2=
=10-7.8mol/L,所以Kb2=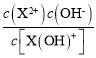 =10-7.8,数量级为10-8,故A正确;
=10-7.8,数量级为10-8,故A正确;
B.X(OH)+的电离平衡常数为Kb2=10-7.8mol/L,根据图象,溶液中c[X(OH)2]=c(X(OH)+]时,溶液的pH=9.2,则溶液中c(OH-)=![]() =
=![]() =10-4.8,所以Kb1=10-4.8,则X(OH)+的水解平衡常数为Ka=
=10-4.8,所以Kb1=10-4.8,则X(OH)+的水解平衡常数为Ka=![]() =10-9.2,则电离程度大于水解程度,溶液显碱性,故B错误;
=10-9.2,则电离程度大于水解程度,溶液显碱性,故B错误;
C.等物质的量的X(NO3)2和X(OH)NO3混合溶液,由于X2+的水解程度大于X(OH)+的水解程度,则溶液中c(X2+)<c[X(OH)+],故C错误;
D.在X(OH)NO3水溶液中存在质子守恒:c(OH-)=c(H+)+c(X2+)- c[X(OH)2],故D正确,
故选:BC。


科目:高中化学 来源: 题型:
【题目】[化学——选修5:有机化学基础]环丙贝特(H)是一种降血脂药物,可明显降低极低密度和低密度脂蛋白水平,并升高高密度脂蛋白,通过改善胆固醇的分布,可减少CH和LDL在血管壁的沉积,还有溶解纤维蛋白和阻止血小板凝聚作用。如图是合成环丙贝特的一种新方法:
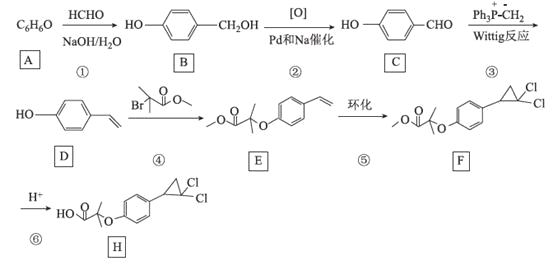
回答下列问题:
(1)C的化学名称为______________________
(2)F中含氧官能团的名称为______________
(3)H的分子式为________________________
(4)反应①的反应类型为___________,反应④的化学方程式为______________________
(5)M为![]() 的同分异构体,能与NaHCO3溶液反应产生气体,则M的结构共有种____(不考虑立体异构);其中1HNMR中有3组峰,且峰面积之比为6:2:1的结构简式为_______
的同分异构体,能与NaHCO3溶液反应产生气体,则M的结构共有种____(不考虑立体异构);其中1HNMR中有3组峰,且峰面积之比为6:2:1的结构简式为_______
(6)利用Wittig反应,设计以环己烷为原料(其他试剂任选),制备![]() 的合成路线:______________________。
的合成路线:______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】HCl和NaOH(待测)中和滴定时计算公式c(NaOH)=______。H2SO4和NaOH(待测)中和滴定时计算公式c(NaOH)=____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、C、D、E为第二至第四周期的元素,其原子序数依次增大。A原子最外层电子数是其内层电子总数的2倍,B原子s轨道上的电子数与p轨道上的电子数相等,C在元素周期表的各元素中电负性最大,D的基态原子核外有6个能级且全部充满电子,E原子基态时未成对电子数是同周期元素中最多的。请回答下列问题:
(1)基态E原子的价电子排布式为____。
(2)A和B中,第一电离能较大的是___(填元素符号);B的简单氢化物的立体构型是__,中心原子的杂化类型是___。
(3)A22-和B22+互为等电子体,B22+的电子式可表示为____,1 mol B22+中含有的π键数目为____。
(4)用氢键表示式写出C的氢化物水溶液中存在的所有氢键_______________。
(5)化合物DC2的晶胞结构如图所示,该离子化合物晶体的密度为a g·cm-3,则晶胞的体积是_____cm3(只要求列算式,阿伏加德罗常数的值为NA)。
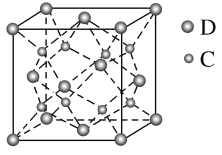
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图装置,将溶液A逐滴加入固体B中,下列叙述正确的是

A. 若A为浓盐酸,B为MnO2,C中盛品红溶液,则C中溶液褪色
B. 若A为醋酸,B为贝壳,C中盛过量澄清石灰水,则C中溶液变浑浊
C. 若A为浓氨水,B为生石灰,C中盛AlCl3溶液,则C中先产生白色沉淀后沉淀又溶解
D. 若A为浓硫酸,B为Na2SO3固体,C中盛石蕊试液,则C中溶液先变红后褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应原理在科研和工农业生产中有广泛应用。
(1)某化学兴趣小组进行工业合成氨的模拟研究,反应的方程式为N2(g)+3H2(g)![]() 2NH3(g) △H<0。在1L蜜闭容器中加入0.1molN2和0.3molH2,实验①、②、③中c(N2)随时间(t)的变化如图所示:
2NH3(g) △H<0。在1L蜜闭容器中加入0.1molN2和0.3molH2,实验①、②、③中c(N2)随时间(t)的变化如图所示:
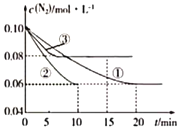
实验②从初始到平衡的过程中,该反应的平均反应速率v(NH3)=___;与实验①相比,实验②和实验③所改变的实验条件分别为下列选项中的___(填字母编号)。
a.增大压强 b.减小压强 c.升高温度 d.降低温度 e.使用催化剂
(2)800K时向下列起始体积相同的密闭容器中充入2molN2、3molH2,甲容器在反应过程中保持压强不变,乙容器保持体积不变,丙是绝热容器,三容器各自建立化学平衡。
①达到平衡时,平衡常数K甲___K乙___K丙(填“>”“<“或“=”)。
②达到平衡时N2的浓度c(N2)甲___c(N2)乙,c(N2)乙___c(N2)丙(填“>”<”或“=”)
③对甲、乙、丙三容器的描述,以下说法正确的是___。
A.乙容器气体密度不再变化时,说明此反应已达到平衡状态
B.在甲中充入稀有气体He,化学反应速率加快
C.向甲容器中充入氨气,正向速率减小,逆向速率增大
D.丙容器温度不再变化时说明已达到平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向20mL0.5mol/L的醋酸溶液中逐滴加入等物质的量浓度的烧碱溶液,测定混合溶液的温度变化如图所示。下列关于混合溶液的相关说法错误的是( )
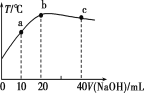
A.醋酸的电离常数:b点>a点
B.由水电离出的c(OH-):b点>c点
C.从a点到b点,混合溶液中可能存在:c(CH3COO-)=c(Na+)
D.b点到c点,混合溶液中一直存在:c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)羰基硫(COS)在常温常压下为有臭鸡蛋气味的无色气体,广泛应用于农药、医药和其他化工生产中。在酸性溶液中可用H2O2氧化COS生成一种强酸(脱硫反应)该脱硫反应的化学方程式为________。
(2)已知:①COS(g)+H2(g)![]() H2S(g)+CO(g)△H1=+11kJ·mo-1;
H2S(g)+CO(g)△H1=+11kJ·mo-1;
②CO(g)+H2O(g)![]() H2(g)+CO2(g) △H2=-21kJ·mol-l;
H2(g)+CO2(g) △H2=-21kJ·mol-l;
③COS(g)+H2O(g)![]() H2S(g)+ CO2(g) △H3=________
H2S(g)+ CO2(g) △H3=________
(3)用活性a-Al2O3催化COS水解,反应为 COS(g)+H2O(g)![]() CO2(g)+H2S(g)在催化剂表面停留时间相同时,不同温度下COS的转化率如图所示。
CO2(g)+H2S(g)在催化剂表面停留时间相同时,不同温度下COS的转化率如图所示。

由图可知,COS的转化率在后期下降的原因可能是________ 。
(4)COS可由CO和H2S在一定条件下反应制得,在刚性容器中发生反应:CO(g)+H2S(g)=COS(g) + H2(g)△H<0。初始时各物质的物质的量浓度与平衡时CO的物质的量浓度数据如下表所示:
实验 | 温度/℃ | 起始时/ molL-1 | 平衡时/ molL-1 | |||
c(CO) | c(H2S) | c(COS) | c(H2) | c(CO) | ||
Ⅰ | T1 | 20.0 | 20.0 | 0 | 0 | 16.0 |
Ⅱ | T2 | 10.0 | 10.0 | 0 | 0 | 7.0 |
Ⅲ | T3 | 7.0 | 8.0 | 2.0 | 4.5 | |
①T1_____(填“大于”“小于”或“等于”)T2。
②实验I中,8 min反应达到平衡,则08 min内v(COS)= _____molL-1,T![]() 时,该反应的平衡常数为_____。
时,该反应的平衡常数为_____。
③实验Ⅲ中的反应应_____(填“正向”或“逆向”)移动。
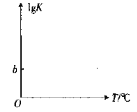
(5)反应COS(g)+H2(g)=H2S(g)+CO(g)的平衡常数K与温度T的关系式为lgK=aT+b(a,b均为常数),请在如图所示的坐标系中用直线画出lgK与温度T的关系图像_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO、SO2是常见的大气污染物,应用化学原理变废为宝,意义重大。
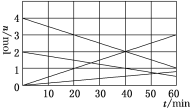
(1)CO与SO2用铝矾土作催化剂、475 ℃条件下反应生成CO2和硫蒸气,该反应可用于从烟道气中回收硫,反应过程中各组分的物质的量与反应时间的关系如图所示,该反应的化学方程式为________。
(2)利用CO可以合成新能源物质——甲醇。其原理为CO(g)+2H2(g)![]() CH3OH(g) ΔH。在压强分别为p1、p2,体积均为V L的两个容器中充入a mol CO、2a mol H2,在催化剂作用下反应生成甲醇,平衡时转化率与温度、压强的关系有下表数据:
CH3OH(g) ΔH。在压强分别为p1、p2,体积均为V L的两个容器中充入a mol CO、2a mol H2,在催化剂作用下反应生成甲醇,平衡时转化率与温度、压强的关系有下表数据:
50 ℃ | 100 ℃ | 200 ℃ | 300 ℃ | 400 ℃ | |
p1 | 0.65 | 0.50 | 0.40 | 0.32 | 0.24 |
p2 | 0.80 | 0.70 | 0.65 | 0.50 | 0.41 |
①ΔH________0,p1________p2。(填“>”“<”或“=”)。
②压强为p2,温度为300 ℃时,该反应的平衡常数K=________。
③压强为p1,温度为100 ℃时,达到平衡后,继续向其中通入0.5a mol CO、a mol H2、0.5a mol CH3OH,则平衡时CH3OH的体积分数________(填“增大”“减小”或“不变”)。
④下列说法正确的是________。
a.当n(CO)∶n(H2)∶n(CH3OH)=1∶2∶1时,可逆反应达到平衡状态
b.平衡后向体积为V L的容器内继续充入He,平衡不移动
c.使用新型催化剂,可提高CO的平衡转化率
(3)MnO2悬浊液、NaOH溶液都是SO2气体常用的吸收剂。
①已知MnO2+SO2=MnSO4,吸收SO2的装置如图所示。反应过程中,为使SO2尽可能转化完全,可采取的合理措施有___________、__________。
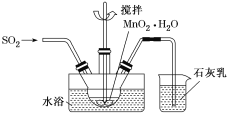
②将标准状况下4.48 L SO2气体缓缓通入100 mL 3 mol·L-1 NaOH溶液中,充分反应后c(Na+)=___ (填几种粒子浓度之和)。
③取②中所得溶液10 mL,加水稀释成1 L,向其中加入CaCl2固体至有沉淀CaSO3(Ksp=3.1×10-7)生成,则所加CaCl2固体的质量为_____mg。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com