
【题目】下列事实不能用化学平衡移动原理解释的是
A.新制氯水长时间放置颜色变浅
B.滴加少量硫酸铜溶液可加快Zn与稀硫酸反应的速率
C.蒸干![]() 溶液无法得到无水
溶液无法得到无水![]()
D.高压比常压更有利于合成氨
【答案】B
【解析】
A.新制氯水中存在Cl2 + H2O![]() HCl +HClO,次氯酸不稳定,容易分解:2HClO=2HCl+O2↑,促进氯气和水反应的平衡正向移动,氯气的浓度减少,氯水的颜色逐渐变浅,能用化学平衡移动原理解释,故A不选;
HCl +HClO,次氯酸不稳定,容易分解:2HClO=2HCl+O2↑,促进氯气和水反应的平衡正向移动,氯气的浓度减少,氯水的颜色逐渐变浅,能用化学平衡移动原理解释,故A不选;
B.滴加少量CuSO4溶液,少量的锌与铜离子反应生成铜,铜与锌和硫酸构成原电池,加快反应速率,不能用化学平衡移动原理解释,故B选;
C.AlCl3溶液中存在Al3++ 3H2O ![]() Al(OH)3+ 3H+,在加热时,促进水解,生成Al(OH)3和氯化氢,氯化氢容易挥发,最终得到氢氧化铝,能用平衡移动原理解释,故C不选;
Al(OH)3+ 3H+,在加热时,促进水解,生成Al(OH)3和氯化氢,氯化氢容易挥发,最终得到氢氧化铝,能用平衡移动原理解释,故C不选;
D.合成氨反应为N2 + 3H2 ![]() 2NH3,是气体体积缩小的可逆反应,增大压强,平衡正向移动,能用勒夏特列原理解释,故D不选;
2NH3,是气体体积缩小的可逆反应,增大压强,平衡正向移动,能用勒夏特列原理解释,故D不选;
故选B。


 浙江名校名师金卷系列答案
浙江名校名师金卷系列答案科目:高中化学 来源: 题型:
【题目】现有反应aA(g)+bB(g) ![]() pC(g),已知:达到平衡后,升高温度,B的转化率变大;减小压强,C的质量分数减小。
pC(g),已知:达到平衡后,升高温度,B的转化率变大;减小压强,C的质量分数减小。
(1)该反应的逆反应是________反应(填“放热”或“吸热”),且a+b______p(填“<”、“>”或“=”)。
(2)温度、容器体积不变,平衡后加入B,A的转化率_________,B的转化率_________。(填“增大”、“减小”或“不变”)
(3)若升高温度,再次平衡时,B、C的浓度之比将_____________。(填“增大”、“减小”或“不变”)
(4)若加入催化剂,再次平衡时气体混合物的总物质的量___________。(填“增大”、“减小”或“不变”)
(5)若B是有色气体,A、C无色,平衡后压缩容器体积为原来的一半,再次平衡时,容器内气体颜色____。若维持容器内气体压强不变,充入Ne,再次平衡时,容器内气体颜色__________。(填“变深”、“变浅”或“不变”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上可由乙苯生产苯乙烯:![]() ,下列说法正确的是
,下列说法正确的是
A. 该反应的类型为消去反应
B. 乙苯的同分异构体共有三种
C. 可用酸性高锰酸钾溶液鉴别乙苯和苯乙烯
D. 乙苯和苯乙烯分子内共平面的碳原子数均为7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于放热反应Zn+H2SO4===ZnSO4+H2↑,下列叙述正确的是( )
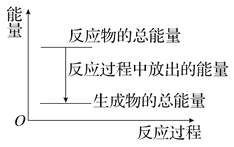
A. 反应过程中的能量关系可用上图表示
B. 1 mol Zn的能量大于1 mol H2的能量
C. 若将其设计为原电池,则锌作正极
D. 若将其设计为原电池,当有32.5 g Zn溶解时,正极放出的气体一定为11.2 L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】依据下图中氮元素及其化合物的转化关系,回答问题:
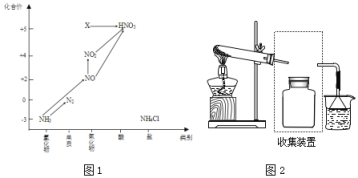
(1)图1中,X的化学式为___,从化合价上看,X具有___性(“氧化”、“还原”)。
(2)回答下列关于NH3的问题:
①实验室常用NH4Cl与Ca(OH)2制取氨气,该反应的化学方程式为________。
②下列试剂不能用于干燥NH3的是___(填字母)。
A.浓硫酸 B.碱石灰 C.NaOH固体
③若要收集一瓶氨气,请将上述装置补充完整,在图2虚框内画出连接图___。
④氨气是重要的化工原料,可以合成多种物质,写出其催化氧化的化学方程式__________________________ 。
(3)回答下列关于NO、NO2的问题:
①汽车排气管上装有催化转化器可减少尾气对环境的污染,汽车尾气中的有害气体CO和NO反应可转化为无害气体排放,写出相关反应的化学方程式:___________________
②NO和NO2按一定比例混合可以被NaOH溶液完全吸收,写出相关化学方程式_____________。
工业生产中利用氨水吸收SO2和NO2,原理如下图所示:
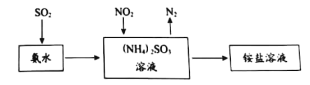
NO2被吸收过程的离子方程式是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】判断A(g)+B(g) ![]() C(g)+D(g)是否达到平衡的依据为( )
C(g)+D(g)是否达到平衡的依据为( )
A. 压强不随时间改变
B. 气体的密度不随时间改变
C. c(A)不随时间改变
D. 单位时间里生成C和D的物质的量相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下N2 + 3H2 2NH3 的反应中,起始N2浓度为2mol/L,H2浓度为5mol/L, 反应到2分钟时,测得 NH3 的反应速率为v(NH3 )=0.4mol/(L·min),填空:
(1) NH3 的转化浓度为c(NH3 )=___________ mol/(L·min)
(2)三段式填空:
(mol/L) N2 + 3H2 2NH3
起始浓度 2 5 0
转化浓度 _ _ _
2min后浓度 _ _ _
(3)用v(N2)表示的反应速率为:v(N2)=__________mol/(L·min)
(4)用v(H2)表示的反应速率为:v(H2)=__________mol/(L·min)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知H+(aq)+OH-(aq)===H2O(l) ΔH=-57.3 kJ·mol-1。回答有关中和反应的问题:
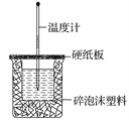
(1)用0.1 mol NaOH配成稀溶液与足量稀硝酸反应,能放出________热量。
(2)如图装置中缺少的仪器名称是_____,碎泡沫塑料的作用______。
(3)用相同浓度和体积的氨水(NH3·H2O)代替NaOH溶液进行上述实验,测得的中和热的数值会___________(填“偏大”、“偏小”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】火山爆发时会喷出SO2,SO2是大气主要污染物之一,在工业中可用于制备硫酸。回答下列问题:
(1)SO2是_____(填“电解质”或“非电解质”)。
(2)Cu2S与O2反应可生成SO2,已知:
Cu(s)+![]() O2(g)=CuO(s) △H=x kJmol-1
O2(g)=CuO(s) △H=x kJmol-1
Cu(s)+![]() S(s)=
S(s)=![]() Cu2S(s) △H=y kJmol-1
Cu2S(s) △H=y kJmol-1
S(s)+O2(g)=SO2(g) △H=z kJmol-1
写出Cu2S与O2反应生成CuO和SO2的热化学方程式__________________________。
(3)硫酸工业中涉及反应:2SO2(g)+O2(g)2SO3(g)△H=Q kJ·mol-1。一定条件下,在2L恒容密闭容器中,通入2molSO2和1molO2发生上述反应,SO2的平衡转化率与压强、温度的关系如图所示。a点时此反应的平衡常数的数值为_____。
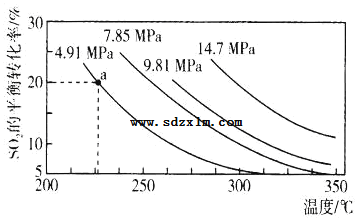
关于该反应,下列说法正确的是____。
A.容器内混合气体的密度不再变化时,反应达到平衡
B.相同时间内生成2molSO2同时消耗1molO2,反应达到平衡
C.Q大于0
D.相同温度下,压强越大,SO2的平衡转化率就越大,该反应的平衡常数就越大
E.反应达到平衡后保持温度不变,再充入2molSO2和1molO2,SO2的平衡转化率增大
F.反应达到平衡后保持温度不变,再充入He(g),SO2的平衡转化率增大
(4)将SO2通入酸化的硝酸钡溶液可生成硫酸钡沉淀,25℃时,KSP(BaSO4)=1×10-10。KSP(BaCO3)=2.6×10-9。该温度下,BaSO4和BaCO3沉淀共存的悬浊液中,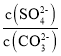 =___。
=___。
(5)用如图装置回收SO2可制得硫酸,电极为惰性电极,a、b膜分别为阳离子交换膜、阴离子交换膜。阳极的电极反应为____。
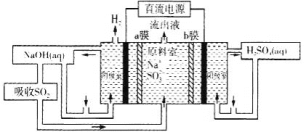
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com