
【题目】火山爆发时会喷出SO2,SO2是大气主要污染物之一,在工业中可用于制备硫酸。回答下列问题:
(1)SO2是_____(填“电解质”或“非电解质”)。
(2)Cu2S与O2反应可生成SO2,已知:
Cu(s)+![]() O2(g)=CuO(s) △H=x kJmol-1
O2(g)=CuO(s) △H=x kJmol-1
Cu(s)+![]() S(s)=
S(s)=![]() Cu2S(s) △H=y kJmol-1
Cu2S(s) △H=y kJmol-1
S(s)+O2(g)=SO2(g) △H=z kJmol-1
写出Cu2S与O2反应生成CuO和SO2的热化学方程式__________________________。
(3)硫酸工业中涉及反应:2SO2(g)+O2(g)2SO3(g)△H=Q kJ·mol-1。一定条件下,在2L恒容密闭容器中,通入2molSO2和1molO2发生上述反应,SO2的平衡转化率与压强、温度的关系如图所示。a点时此反应的平衡常数的数值为_____。
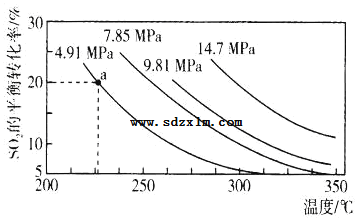
关于该反应,下列说法正确的是____。
A.容器内混合气体的密度不再变化时,反应达到平衡
B.相同时间内生成2molSO2同时消耗1molO2,反应达到平衡
C.Q大于0
D.相同温度下,压强越大,SO2的平衡转化率就越大,该反应的平衡常数就越大
E.反应达到平衡后保持温度不变,再充入2molSO2和1molO2,SO2的平衡转化率增大
F.反应达到平衡后保持温度不变,再充入He(g),SO2的平衡转化率增大
(4)将SO2通入酸化的硝酸钡溶液可生成硫酸钡沉淀,25℃时,KSP(BaSO4)=1×10-10。KSP(BaCO3)=2.6×10-9。该温度下,BaSO4和BaCO3沉淀共存的悬浊液中,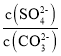 =___。
=___。
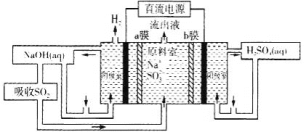
(5)用如图装置回收SO2可制得硫酸,电极为惰性电极,a、b膜分别为阳离子交换膜、阴离子交换膜。阳极的电极反应为____。
【答案】非电解质 Cu2S(s)+2O2(g)=2CuO(s)+SO2(g) △H=(2x+z―2y)kJ·mol-1 ![]() 或0.15625 BE
或0.15625 BE ![]() SO32--2e-+H2O=SO42-+2H+
SO32--2e-+H2O=SO42-+2H+
【解析】
(1)根据电解质、非电解质的定义判断;
(2)根据盖斯定律和热化学方程式进行书写;
(3)首先根据图像确定二氧化硫的平衡转化率,再列出三段式,确定平衡时刻各物质的浓度,进而计算平衡常数;
A.用于判断平衡状态的量一定得是“变化的量”不变了,才可以判断反应达到平衡状态;
B. 反应处于平衡状态时各物质的量保持不变,据此分析;
C.根据温度对平衡移动的影响进行判断;
D.根据压强对平衡移动的影响进行判断,且平衡常数只与温度有关;
E.根据压强对平衡移动的影响进行判断;
F.恒温恒容,向反应体系中充入无关气体时,正逆反应速率不变,平衡不移动;
(4)根据溶度积常数进行计算;
(5)该装置可回收SO2制得硫酸,硫酸在阳极生成,SO32-通过阴离子交换膜进入阳极室,电极反应式的书写也要遵循得失电子守恒、电荷守恒、元素守恒,据此写出阳极的电极反应式。
(1)电解质是指在水溶液中或熔融状态下能够导电的化合物,但一定是自身能电离出阴阳离子而导电,二氧化硫溶于水后,能导电,但阴阳离子不是其自身电离出来的,而是与水反应生成的亚硫酸电离出来的,因此二氧化硫是非电解质,亚硫酸是电解质;
故答案为:非电解质;
(2)反应① Cu(s)+![]() O2(g)=CuO(s) △H=x kJ·mol-1
O2(g)=CuO(s) △H=x kJ·mol-1
反应② Cu(s)+![]() S(s)=
S(s)=![]() Cu2S(s) △H=y kJ·mol-1
Cu2S(s) △H=y kJ·mol-1
反应③ S(s)+O2(g)=SO2(g) △H=z kJ·mol-1
根据盖斯定律可知,①×2-②×2+③可得
Cu2S(s)+2O2(g)=2CuO(s)+SO2(g) △H=(2x+z―2y)kJ·mol-1;
故答案为:Cu2S(s)+2O2(g)=2CuO(s)+SO2(g) △H=(2x+z―2y)kJ·mol-1;
(3)由图像可知a点时SO2的平衡转化率为20%,则SO2的转化量为0.4mol,列出三段式:
2SO2(g) + O2(g) 2SO3(g)
起始(mol/L) 1mol/L 0.5mol/L 0
转化(mol/L) 0.2mol/L 0.1mol/L 0.2mol/L
平衡(mol/L) 0.8mol/L 0.4mol/L 0.2mol /L
则平衡常数为:![]() ;
;
故答案为:![]() 或0.15625;
或0.15625;
A.容器为恒容密闭容器,混合气体的总质量不变,因此容器内混合气体的密度始终不变,则容器内混合气体的密度不再变化时,反应不一定达到平衡状态,A项错误;
B.相同时间内生成2molSO2的同时生成1mol O2,若同时又消耗1molO2,那么O2的物质的量保持不变,反应达到平衡状态,B项正确;
C.由图像可知,当压强一定时,升高温度,SO2的平衡转化率减小,即平衡逆向移动,而升温平衡向吸热反应方向移动,因此正反应方向为放热方向,则Q小于0,C项错误;
D.相同温度下,增大压强,平衡向气体体积减小的方向移动,而该反应正反应方向为气体体积减小的反应,因此,加压该反应正向移动,则SO2的平衡转化率增大,但平衡常数只与温度有关,温度不变,平衡常数不变,D项错误;
E.恒温恒容,反应达到平衡后再充入2molSO2和1molO2,与原平衡相比,新平衡同等程度改变反应物的物质的量,相当于增大压强,平衡正向移动,SO2的平衡转化率增大,E项正确;
F.恒温恒容,反应达到平衡后再充入He(g),因为容器容积不变,反应混合物中各物质的物质的量浓度均不变,正逆反应速率不变,平衡不移动,SO2的平衡转化率不变,F项错误;
综上所述,BE正确;
故答案为:BE;
(4)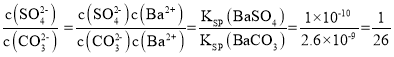 ;
;
故答案为:![]() ;
;
(5)该装置可回收SO2制得硫酸,硫酸在阳极生成,SO32-通过阴离子交换膜进入阳极室,电极反应式的书写也要遵循得失电子守恒、电荷守恒、元素守恒,阳极的电极反应为SO32--2e-+H2O=SO42-+2H+;
故答案为:SO32--2e-+H2O=SO42-+2H+。


 期末100分闯关海淀考王系列答案
期末100分闯关海淀考王系列答案 小学能力测试卷系列答案
小学能力测试卷系列答案科目:高中化学 来源: 题型:
【题目】下列事实不能用化学平衡移动原理解释的是
A.新制氯水长时间放置颜色变浅
B.滴加少量硫酸铜溶液可加快Zn与稀硫酸反应的速率
C.蒸干![]() 溶液无法得到无水
溶液无法得到无水![]()
D.高压比常压更有利于合成氨
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示三个烧瓶中分别装入含酚酞的0.01 mol·L-1 CH3COONa溶液,并分别放置在盛有水的烧杯中,然后向烧杯①中加入生石灰;向烧杯③中加入NH4NO3晶体;烧杯②中不加任何物质。
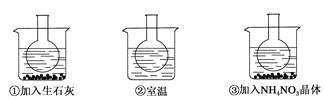
(1)含酚酞的0.01 mol·L-1 CH3COONa溶液显浅红色的原因为________(请写出相应的离子方程式和必要的文字说明)。
(2)实验过程中发现烧瓶①中溶液红色变深,烧瓶③中溶液红色变浅,则下列叙述正确的是_____。
A.水解反应为放热反应 B.水解反应为吸热反应
C.NH4NO3溶于水时放出热量 D.NH4NO3溶于水时吸收热量
(3)向0.01 mol·L-1 CH3COONa溶液中分别加入少量浓盐酸、NaOH固体、Na2CO3固体、FeSO4固体,使CH3COO-水解平衡移动的方向分别为____、___、____、____(填“左”“右”或“不移动”)。
(4)已知室温时,CH3COOH电离常数为1.75×10-5,NH3·H2O电离常数为1.75×10-5。浓度均为0.1 mol·L-1的下列溶液:①CH3COONa、②NH4Cl、③CH3COONH4、④(NH4)2SO4,pH由小到大排列的正确顺序为 ____。
查看答案和解析>>
科目:高中化学 来源: 题型:
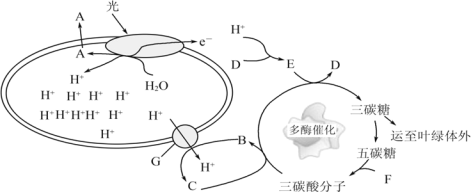
【题目】(下图为某植物的光合作用过程模式图,字母 A-G 表示物质或结构,二烷氨基乙醇羧酸脂(DA-6)是一种新型的叔胺类植物生长调节剂。某科研小组研究了 DA-6 对西瓜光合作用的影响,其相关指标测定(Rubisco 是碳反应的关键酶)结果如下表:
D A - 6 对西瓜光合作用的影响实验结果记录表
组 别 | 处理 | 光合速率 | 气孔导度 | 胞间二氧化碳浓度 | Rubisco 活性 |
(mmolm-2s-1) | (mmolm-2s-1) | (mmolm-2s-1) | (umolm-2s-1) | ||
① | 不遮光+清水 | 10.1 | 0.16 | 260 | 38.2 |
② | 不遮光+DA-6 | 15.2 | 0.24 | 255 | 42.1 |
③ | 遮光+清水 | 8.3 | 0.14 | 278 | 25.3 |
④ | 遮光+DA-6 | 13.4 | 0.23 | 269 | 35.7 |
(1)图中产生物质 A 的结构是___________________________,D 物质为___________________________。
(2)据图推测类囊体腔中积累H+的生理意义最可能是___________________________。
(3)突然停止光照,短期内三碳酸分子的含量将会___________________________。
(4)胞间 CO2 进入叶绿体内参与卡尔文循环,该过程生成 3 个 RuBP 需消耗___________________________个三碳糖磷酸,RuBP 的元素组成为__________________________。
(5)气孔导度表示气孔开放的程度。该研究能说明气孔导度不是遮光条件下光合速率下降的主要限制因素,可以证明此结论的实验组别是___________
A.① ② B.① ③ C.③ ④ D.② ④
(6)DA-6 可提高西瓜叶片的光合速率。从表数据进行推测,DA-6 提高西瓜叶片光合速率作用机制是:DA-6 通过__________________________,从而提高光合作用的速率。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用图所示装置检验乙烯时不需要除杂的是
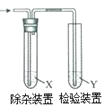
乙烯的制备 | 试剂X | 试剂Y | |
A | CH3CH2Br与NaOH乙醇溶液共热 | H2O | KMnO4酸性溶液 |
B | CH3CH2Br与NaOH乙醇溶液共热 | H2O | Br2的CCl4溶液 |
C | CH3CH2OH与浓H2SO4共热至170℃ | NaOH溶液 | KMnO4酸性溶液 |
D | CH3CH2OH与浓H2SO4共热至170℃ | NaOH溶液 | Br2的CCl4溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从柑橘中炼制出有机物 ,下列有关该有机物的推测正确的是()
,下列有关该有机物的推测正确的是()
A. 分子式为C10H14B. 常温下为液态,难溶于水
C. 属于芳香烃D. 1 mol该物质与1 mol HCl加成所得产物有2种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物I(分子式为C19H20O4)属于芳香酯类物质,是一种调香剂,其合成路线如下:

已知:①A属于脂肪烃,核磁共振氢谱显示有2组峰,面积比为3:1,其蒸气密度是相同条件下H2的28倍;D分子式为C4H8O3;E分子式为C4H6O2,能使溴水褪色。
②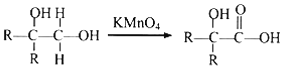 其中R为烃基。
其中R为烃基。
③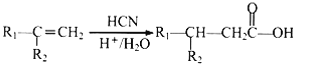 其中R1和R2均为烃基。
其中R1和R2均为烃基。
回答下列问题:
(1)A的结构简式为___________________。
(2)D中官能团的名称是______________________。
(3)反应②的化学方程式为______________。
(4)E的同系物K比E多一个碳原子,K有多种链状同分异构体,其中能发生银镜反应且能水解的有_______种。
(5)反应①~⑦属于取代反应的是__________(填序号)。
(6)反应⑦的化学方程式为_________________。
(7)参照上述合成路线,以 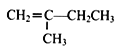 为原料(无机试剂任选),经4步反应制备可降解塑料
为原料(无机试剂任选),经4步反应制备可降解塑料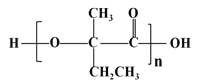 _____________。
_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知酸性: ![]() >H2CO3>
>H2CO3>![]() >HCO3-;现要将
>HCO3-;现要将![]() 转变为
转变为 ![]() ,可行的方法是
,可行的方法是
A.向该溶液中加入足量的稀硫酸,加热
B.将该物质与稀硫酸共热后,再加入足量的NaOH溶液
C.将该物质与足量的NaOH溶液共热,再通入足量CO2气体
D.将该物质与稀硫酸共热后,再加入足量的Na2CO3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化氯(ClO2)是高效安全的饮用水消毒剂,得到越来越广泛的应用。回答下列问题:
I.实验室合成ClO2常用盐酸或双氧水还原氯酸钠(NaClO3)。
(1)盐酸和NaClO3反应时有ClO2和Cl2生成,书写反应的离子方程式并标出电子转移的方向和数目______________________________________,当反应中转移0.2mol电子时,参加反应的还原剂的物质的量为________________________________。
(2)使用双氧水作还原剂的优点是_________________________________________。
II.当pH≤2.0时,NaClO2能被I 完全还原成Cl;(离子反应方程式为ClO2+4H++4I→2I2+Cl+2H2O)。回答下列问题:
溶液中Na2S2O3能与I2反应生成NaI和Na2S4O6(2Na2S2O3+I2→2NaI+Na2S4O6)。欲测定成品中NaClO2的含量,现进行如下操作:
步骤Ⅰ | 称取样品Wg配成溶液置于锥形瓶中,并调节pH≤2.0 |
步骤Ⅱ | 向锥形瓶中加入足量KI晶体,充分搅拌,并加入少量指示剂 |
步骤Ⅲ | 用c mol/L的Na2S2O3溶液滴定发生反应 |
(1)步骤Ⅱ加入指示剂的名称是_______________。滴定终点时溶液的颜色变化为_________。
(2)若上述滴定操作中平均消耗VmL Na2S2O3标准溶液,则成品中NaClO2的质量分数为__________(用含W、c、V的代数式表示)。
(3)ClO2和Cl2均能将电镀废水中的CN 氧化为无毒的物质,自身被还原为Cl,处理含相同量CN的电镀废水,所需Cl2的物质的量是ClO2的___倍。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com