
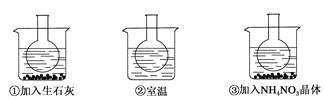
【题目】如图所示三个烧瓶中分别装入含酚酞的0.01 mol·L-1 CH3COONa溶液,并分别放置在盛有水的烧杯中,然后向烧杯①中加入生石灰;向烧杯③中加入NH4NO3晶体;烧杯②中不加任何物质。
(1)含酚酞的0.01 mol·L-1 CH3COONa溶液显浅红色的原因为________(请写出相应的离子方程式和必要的文字说明)。
(2)实验过程中发现烧瓶①中溶液红色变深,烧瓶③中溶液红色变浅,则下列叙述正确的是_____。
A.水解反应为放热反应 B.水解反应为吸热反应
C.NH4NO3溶于水时放出热量 D.NH4NO3溶于水时吸收热量
(3)向0.01 mol·L-1 CH3COONa溶液中分别加入少量浓盐酸、NaOH固体、Na2CO3固体、FeSO4固体,使CH3COO-水解平衡移动的方向分别为____、___、____、____(填“左”“右”或“不移动”)。
(4)已知室温时,CH3COOH电离常数为1.75×10-5,NH3·H2O电离常数为1.75×10-5。浓度均为0.1 mol·L-1的下列溶液:①CH3COONa、②NH4Cl、③CH3COONH4、④(NH4)2SO4,pH由小到大排列的正确顺序为 ____。
【答案】CH3COONa溶液中存在如下水解平衡:CH3COO-+H2OCH3COOH+OH-,使溶液呈碱性 BD 右 左 左 右 ④<②<③<①
【解析】
(1) CH3COONa是强碱弱酸盐,水解呈碱性;
(2)向烧杯①中加入生石灰,生石灰与水反应放热,温度升高;烧瓶③中溶液红色变浅,说明CH3COO-+H2OCH3COOH+OH-平衡逆向移动;
(3)根据影响平衡移动的因素分析;
(4)根据盐水解分析;
(1) CH3COONa溶液中存在如下水解平衡:CH3COO-+H2OCH3COOH+OH-,使溶液呈碱性,所以溶液显浅红色;
(2)向烧杯①中加入生石灰,生石灰与水反应放热,温度升高,烧瓶①中溶液红色变深,说明CH3COO-+H2OCH3COOH+OH-平衡正向移动,水解反应为吸热反应,故A错误、B正确;水解反应为吸热反应,烧瓶③中溶液红色变浅,说明CH3COO-+H2OCH3COOH+OH-平衡逆向移动,NH4NO3溶于水时吸收热量,故C错误、D正确。
(3)向0.01 mol·L-1 CH3COONa溶液中加入少量浓盐酸,氢氧根离子离子浓度减小,CH3COO-+H2OCH3COOH+OH-正向移动;向0.01 mol·L-1 CH3COONa溶液中加入少量NaOH固体,氢氧根离子浓度增大,CH3COO-+H2OCH3COOH+OH-逆向移动;向0.01 mol·L-1 CH3COONa溶液中加入少量Na2CO3固体,氢氧根离子浓度增大,CH3COO-+H2OCH3COOH+OH-逆向移动;向0.01 mol·L-1 CH3COONa溶液中加入少量FeSO4固体,氢氧根离子浓度减小,CH3COO-+H2OCH3COOH+OH-正向移动;
(4)①CH3COONa强碱弱酸盐,水解呈碱性、②NH4Cl是强酸弱碱盐,水解呈酸性、③CH3COONH4 是弱酸弱碱盐,水解程度相同,溶液呈中性、④(NH4)2SO4强酸弱碱盐,溶液呈酸性,铵根离子浓度大于NH4Cl,酸性比NH4Cl溶液强,故pH由小到大排列的正确顺序为④<②<③<①。


 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案科目:高中化学 来源: 题型:
【题目】工业上可由乙苯生产苯乙烯:![]() ,下列说法正确的是
,下列说法正确的是
A. 该反应的类型为消去反应
B. 乙苯的同分异构体共有三种
C. 可用酸性高锰酸钾溶液鉴别乙苯和苯乙烯
D. 乙苯和苯乙烯分子内共平面的碳原子数均为7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下N2 + 3H2 2NH3 的反应中,起始N2浓度为2mol/L,H2浓度为5mol/L, 反应到2分钟时,测得 NH3 的反应速率为v(NH3 )=0.4mol/(L·min),填空:
(1) NH3 的转化浓度为c(NH3 )=___________ mol/(L·min)
(2)三段式填空:
(mol/L) N2 + 3H2 2NH3
起始浓度 2 5 0
转化浓度 _ _ _
2min后浓度 _ _ _
(3)用v(N2)表示的反应速率为:v(N2)=__________mol/(L·min)
(4)用v(H2)表示的反应速率为:v(H2)=__________mol/(L·min)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知H+(aq)+OH-(aq)===H2O(l) ΔH=-57.3 kJ·mol-1。回答有关中和反应的问题:
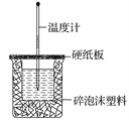
(1)用0.1 mol NaOH配成稀溶液与足量稀硝酸反应,能放出________热量。
(2)如图装置中缺少的仪器名称是_____,碎泡沫塑料的作用______。
(3)用相同浓度和体积的氨水(NH3·H2O)代替NaOH溶液进行上述实验,测得的中和热的数值会___________(填“偏大”、“偏小”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于下列各装置图的叙述中,正确的是
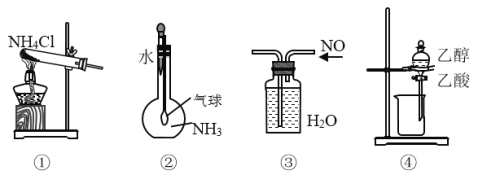
A.实验室用装置①制取氨气B.装置②用于证明氨气极易溶于水
C.装置③用于排水集气法收集NOD.装置④用于分离乙酸与乙醇
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分,请参照元素①-⑧在表中的位置,回答下列问题:
族 周期 | ⅠA | 0 | ||||||
1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
2 | ② | ③ | ④ | |||||
3 | ⑤ | ⑥ | ⑦ | ⑧ |
(1)③、④、⑤的原子半径由大到小的顺序为______(用元素符号回答)。
(2)②、③、⑦的最高价氧化物对应的水化物酸性由强到弱的顺序是_____。(用化学式回答)
(3)由①、④、⑤三种元素形成化合物的电子式______ 。
(4)⑥的单质与NaOH溶液反应的离子方程式_______。
(5)⑦的氢化物是一种无色气体,遇到空气能发生爆炸性自燃。已知室温下1 g氢化物自燃放出45.0 kJ的热量(产物水为液态),其热化学方程式为_________。
(6)由表中元素形成的常见物质A、B、C、D、E、F转化关系如下图所示。已知:A是常见的气态氢化物,B是能使带火星的木条复燃的无色无味气体, E的相对分子质量比D大17 ,D为红棕色气体(部分反应中生成物没有全部列出,反应条件未列出)

①A的结构式为_______。
②A和B反应生成C和F的化学方程式为_______,反应Ⅰ的离子方程式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由CH3CH2CH2Br制备CH3CH(OH)CH2OH,依次发生的反应类型和反应条件都正确的是
选项 | 反应类型 | 反应条件 |
A | 加成、取代、消去 | KOH醇溶液/加热、KOH水溶液/加热、常温 |
B | 消去、加成、取代 | NaOH醇溶液/加热、常温、KOH水溶液/加热 |
C | 氧化、取代、消去 | 加热、KOH醇溶液/加热、KOH水溶液/加热 |
D | 消去、加成、水解 | NaOH水溶液/加热、常温、NaOH醇溶液/加热 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】火山爆发时会喷出SO2,SO2是大气主要污染物之一,在工业中可用于制备硫酸。回答下列问题:
(1)SO2是_____(填“电解质”或“非电解质”)。
(2)Cu2S与O2反应可生成SO2,已知:
Cu(s)+![]() O2(g)=CuO(s) △H=x kJmol-1
O2(g)=CuO(s) △H=x kJmol-1
Cu(s)+![]() S(s)=
S(s)=![]() Cu2S(s) △H=y kJmol-1
Cu2S(s) △H=y kJmol-1
S(s)+O2(g)=SO2(g) △H=z kJmol-1
写出Cu2S与O2反应生成CuO和SO2的热化学方程式__________________________。
(3)硫酸工业中涉及反应:2SO2(g)+O2(g)2SO3(g)△H=Q kJ·mol-1。一定条件下,在2L恒容密闭容器中,通入2molSO2和1molO2发生上述反应,SO2的平衡转化率与压强、温度的关系如图所示。a点时此反应的平衡常数的数值为_____。
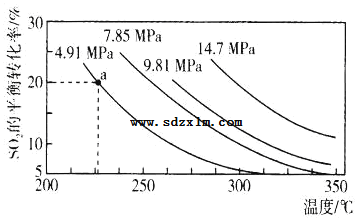
关于该反应,下列说法正确的是____。
A.容器内混合气体的密度不再变化时,反应达到平衡
B.相同时间内生成2molSO2同时消耗1molO2,反应达到平衡
C.Q大于0
D.相同温度下,压强越大,SO2的平衡转化率就越大,该反应的平衡常数就越大
E.反应达到平衡后保持温度不变,再充入2molSO2和1molO2,SO2的平衡转化率增大
F.反应达到平衡后保持温度不变,再充入He(g),SO2的平衡转化率增大
(4)将SO2通入酸化的硝酸钡溶液可生成硫酸钡沉淀,25℃时,KSP(BaSO4)=1×10-10。KSP(BaCO3)=2.6×10-9。该温度下,BaSO4和BaCO3沉淀共存的悬浊液中,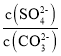 =___。
=___。
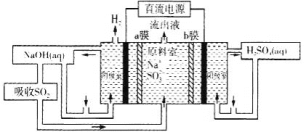
(5)用如图装置回收SO2可制得硫酸,电极为惰性电极,a、b膜分别为阳离子交换膜、阴离子交换膜。阳极的电极反应为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将1.92 g Cu和一定量的浓HNO3反应,随着Cu的不断减少,反应生成气体的颜色逐渐变浅,当Cu反应完毕时,共收集到气体1.12 L(标准状况),则反应中消耗HNO3的物质的量为
A.0.1 molB.0.05 molC.0.15 molD.0.11 mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com