
【题目】关于下列各装置图的叙述中,正确的是
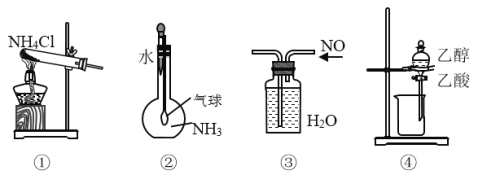
A.实验室用装置①制取氨气B.装置②用于证明氨气极易溶于水
C.装置③用于排水集气法收集NOD.装置④用于分离乙酸与乙醇
 金钥匙试卷系列答案
金钥匙试卷系列答案科目:高中化学 来源: 题型:
【题目】高磷鲕状赤铁矿(主要含有![]() 、少量
、少量![]() 、CaO,
、CaO,![]() 等)是我国一种重要的沉积型铁矿资源,以高磷鲕状赤铁矿为原料制备纯度较高的铁红,其流程如图所示。下列说法错误的是
等)是我国一种重要的沉积型铁矿资源,以高磷鲕状赤铁矿为原料制备纯度较高的铁红,其流程如图所示。下列说法错误的是

A. 铁红可用于油漆、油墨、建筑物着色剂
B. 酸浸液遇![]() 溶液生成蓝色沉淀
溶液生成蓝色沉淀
C. 洗涤滤渣时要用玻璃棒不断搅拌
D. 氧化时选用的试剂可以是![]() 、NaClO溶液
、NaClO溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从葡萄籽中提取的原花青素结构如图,具有生物活性,如抗氧化和自由基清除能力等。有关原花青素的下列说法不正确的是

A. 该物质可以看作醇类,也可看做酚类
B. 1 mol该物质可与4 mol Br2反应
C. 1 mol该物质可与7 mol NaOH反应
D. 1 mol该物质可与7 mol Na反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】松油醇是一种调香香精,它是α、β、γ三种同分异构体组成的混合物,可由松节油分馏产品A(下式中的18是为区分两个羟基而人为加上去的)经下列反应制得:
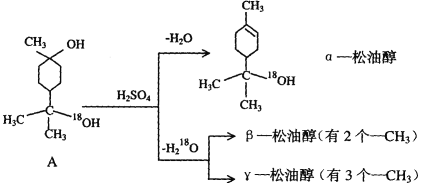
(1)A分子中的官能团名称是_________________。
(2)A分子能发生的反应类型是________。
a.加成 b.取代 c.催化氧化 d.消去
(3)α-松油醇的分子式_________________。
(4)α-松油醇所属的有机物类别是________。
a.酸 b.醛 c.烯烃 d.不饱和醇
(5)写结构简式:β-松油醇_____________,γ-松油醇_____________。
(6)写出α-松油醇与乙酸发生酯化反应的方程:___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应N2(g)+3H2(g)![]() 2NH3(g) ΔH<0,若在恒压绝热容器中发生,下列选项表明反应一定已达平衡状态的是 ( )
2NH3(g) ΔH<0,若在恒压绝热容器中发生,下列选项表明反应一定已达平衡状态的是 ( )
A. 容器内的温度不再变化
B. 容器内的压强不再变化
C. 相同时间内,断开1molH-H键的同时断开2molN-H键
D. 容器内气体的浓度c(N2):c(H2):c(NH3)=1:3:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示三个烧瓶中分别装入含酚酞的0.01 mol·L-1 CH3COONa溶液,并分别放置在盛有水的烧杯中,然后向烧杯①中加入生石灰;向烧杯③中加入NH4NO3晶体;烧杯②中不加任何物质。
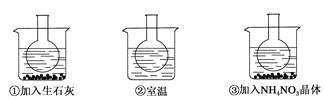
(1)含酚酞的0.01 mol·L-1 CH3COONa溶液显浅红色的原因为________(请写出相应的离子方程式和必要的文字说明)。
(2)实验过程中发现烧瓶①中溶液红色变深,烧瓶③中溶液红色变浅,则下列叙述正确的是_____。
A.水解反应为放热反应 B.水解反应为吸热反应
C.NH4NO3溶于水时放出热量 D.NH4NO3溶于水时吸收热量
(3)向0.01 mol·L-1 CH3COONa溶液中分别加入少量浓盐酸、NaOH固体、Na2CO3固体、FeSO4固体,使CH3COO-水解平衡移动的方向分别为____、___、____、____(填“左”“右”或“不移动”)。
(4)已知室温时,CH3COOH电离常数为1.75×10-5,NH3·H2O电离常数为1.75×10-5。浓度均为0.1 mol·L-1的下列溶液:①CH3COONa、②NH4Cl、③CH3COONH4、④(NH4)2SO4,pH由小到大排列的正确顺序为 ____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】弱电解质的水溶液中存在电离平衡。
(1)醋酸是常见的弱酸。
①醋酸在水溶液中的电离方程式为 ___________________。
②下列方法中,可以使醋酸稀溶液中 CH3COOH 电离程度增大的是 __________________(填字母序号)。
a 滴加少量浓盐酸 b 微热溶液 c 加水稀释 d 加入少量醋酸钠晶体
(2)用 0.1 mol·L-1NaOH 溶液分别滴定体积均为 20.00 mL、浓度均为 0.1 mol·L-1的盐酸和醋酸溶液,得到滴定过程中溶液 pH随加入 NaOH溶液体积而变化的两条滴定曲线。

①滴定醋酸的曲线是_______________(填“I”或“II”)。
②室温时,若 0.1 mol·L-1的醋酸的电离度为 1%,计算这醋酸溶液的 pH 值________。
③滴定开始前,三种溶液中由水电离出的 c(H+)最大的是________________。
④上述用 0.1 mol·L-1的 NaOH 溶液滴定 0.1 mol·L-1的盐酸,下列操作不正确的是________________。
A.用标准 NaOH 溶液润洗碱式滴定管后,再装入标准碱溶液
B.用待测酸溶液润洗锥形瓶后,再装入待测酸溶液
C.滴定时两眼应注视滴定管中液面的变化,以免滴定过量
D.读数时,视线应与滴定管凹液面的最低点保持水平
⑤上述滴定用酚酞作指示剂,滴定终点的现象_______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用图所示装置检验乙烯时不需要除杂的是
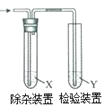
乙烯的制备 | 试剂X | 试剂Y | |
A | CH3CH2Br与NaOH乙醇溶液共热 | H2O | KMnO4酸性溶液 |
B | CH3CH2Br与NaOH乙醇溶液共热 | H2O | Br2的CCl4溶液 |
C | CH3CH2OH与浓H2SO4共热至170℃ | NaOH溶液 | KMnO4酸性溶液 |
D | CH3CH2OH与浓H2SO4共热至170℃ | NaOH溶液 | Br2的CCl4溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知Ksp(CaCO3)=2.8×10-9及表中有关信息:
弱酸 | CH3COOH | H2CO3 |
电离平衡常数(常温) | Ka=1.8×10-5 | Ka1=4.3×10-7; Ka2=5.6×10-11 |
下列判断正确的是
A. 向Na2CO3溶液中滴入酚酞,溶液变红,主要原因是CO32-+2H2O![]() H2CO3+2OH-
H2CO3+2OH-
B. 常温时,CH3COOH与CH3COONa混合溶液的pH=6,则 =18
=18
C. NaHCO3溶液中:c(OH-)-c(H+)=c(H2CO3)-c(CO32-)
D. 2×10-4 mol/L的Na2CO3溶液与CaCl2溶液等体积混合出现沉淀,则CaCl2溶液的浓度一定是5.6×10-5 mol/L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com