
����Ŀ��ij�о���ѧϰС������ȷ�Ӧʵ��չ���о������и��л�ѧ�̲��жԡ����ȷ�Ӧ�� ������������������������Ӧ�ų��������ȣ�������ҫ�۵Ĺ�â������ֽ©�����²����մ����� ����������ɳ�С������ġ���ѧ�ֲᡷ֪��Al��Al2O3��Fe��Fe2O3���ۡ��е��������£�
���� | Al | Al2O3 | Fe | Fe2O3 |
�۵�/�� | 660 | 2 054 | 1535 | 1462 |
�е�/�� | 2467 | 2980 | 2750 | �� |
I.��1��ijͬѧ�Ʋ⣬���ȷ�Ӧ���õ���������Ӧ�������Ͻ������ǣ��÷�Ӧ�ų�������ʹ���ۻ����������۵�����ĵͣ���ʱҺ̬���������ۺ��γ������Ͻ�����Ϊ���Ľ����Ƿ������________(�������������������
��2����֭һ����ʵ�鷽����֤���������õĿ�״�������к��н���������ʵ�������Լ���________����Ӧ�����ӷ���ʽΪ___________��
II.ʵ���о����֣����ᷢ��������ԭ��Ӧʱ�������Ũ��Խϡ����Ӧ��ԭ�����е�Ԫ�صĻ��ϼ�Խ�͡�ijͬѧȡһ������������������һ������ϡ�������ַ�Ӧ����Ӧ������������ų�������������ΪFe3+���ڷ�Ӧ���������Һ�У���μ���4mol/L������������Һ����������������Һ�������mL)������ij��������ʵ�����mol���Ĺ�ϵ��ͼ��ʾ��
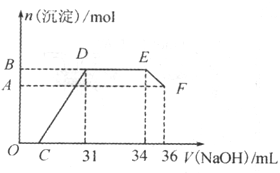
�ش��������⣺
��1��ͼ��OC��û�г������ɣ��˽η�����Ӧ�����ӷ���ʽΪ____________����DE�Σ����������ʵ���û�б仯����˽η�����Ӧ�����ӷ���ʽΪ____________��
��2��B��A�IJ�ֵΪ_________mol��B���Ӧ�ij��������ʵ���Ϊ___________mol��C���Ӧ������������Һ�����Ϊ____________mL��
���𰸡�I��1������ ��2��NaOH��Һ 2Al+2OH-+2H2O=2AlO2-+3H2����
II��1�� H++OH-=H2O NH4++OH-=NH3��H2O����2��0.008 0.032mol 7mL
�����������������I����1���÷�Ӧ�ų�������ʹ���ۻ����������۵�����ͣ���ʱ��Ӧ������Һ̬�������������ۺ��γ������Ͻ��������Ľ����Ǻ����ģ�
��2������Al�ܹ���ǿ����Һ������Ӧ������������Fe��Al���ܷ�����Ӧ�����ʼ�����֤�����Ը�ʵ�������Լ���NaOH��Һ����Ӧ�Ļ�ѧ����ʽ�ǣ�2Al+2OH-+2H2O=2AlO2-+3H2����
II����1�����������ܽ�ý�������Һ�м���NaOH��Һ������������������������������NaOH������������ᷢ���кͷ�Ӧ������OC�����ӷ���ʽ�ǣ�H++OH-=H2O��
��2����CD����Һ�е�Fe3+��Al3+����������Ӧ�γ�Fe(OH)3��Al(OH)3��������DE�Σ����������ʵ���û�б仯������Ϊ��DE��NaOH��Һ�����ᱻ��ԭΪNH4NO3,���߷������ֽⷴӦ�����ӷ���ʽ�ǣ�NH4++ OH-=NH3��H2O��
��3����EF��NaOH�ܽ�Al(OH)3���������ӷ���ʽ�ǣ�Al(OH)3+ OH-=AlO2-+ 2H2O���ܽ�Al(OH)3���ĵ�NaOH�����ʵ�����n(NaOH)=4mol/L��0.002L=0.008mol�����Ը��ݷ�Ӧ����ʽ�ж��ߵ����ʵ�����ϵ��֪��n(Al(OH)3)=0.008mol������Al(OH)3�������ĵ�NaOH��Һ�������6mL�����ݷ�Ӧ����ʽNH4++ OH-=NH3��H2O ��֪��n(NH4+) = 4mol/L �� 0.003L = 0.012mol��n(e-) =" 0.012mol" �� 8 = 0.096mol��Fe��Al����+3�۵Ľ����������ڷ�Ӧ�����е���ת����Ŀ��ȣ�����n(Fe)+n(Al) =" 0.096mol��3" = 0.032mol��������B���Ӧ�ij��������ʵ�������������ʵ�����ȣ�Ϊ0.032mol��ʹAl3+��Fe3+�γɳ������ĵ�NaOH�����ʵ�������ӵ����ʵ�����ȣ���0.096mol����������NaOH��Һ�������V��NaOH�� =" 0.096mol" ��4mol/L =" 0.024L" = 24mL������ C���Ӧ������������Һ�����Ϊ31mL-24mL = 7mL��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾһ�����أ�װ�е��Һa��X��Y������缫�壬ͨ��������ֱ����Դ��������ش��������⣺
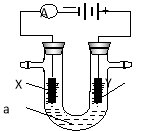
��1����X��Y���Ƕ��Ե缫��a�DZ���NaCl��Һ��ʵ�鿪ʼʱ��ͬʱ�����߸����뼸�η�̪��Һ����
�ٵ�����X���ϵĵ缫��ӦʽΪ ��
��X�������۲쵽��ʵ�������� ��
��Y�缫�ǵ��ص� �����õ缫�ϵĵ缫��ӦʽΪ ��
��2����Ҫ�õ�ⷽ��������ͭ�����Һaѡ��CuSO4��Һ����
��X�缫�IJ����� ���缫��ӦʽΪ ��
��Y�缫�IJ����� ���缫��ӦʽΪ ��
��˵�������ʷ����ĵ缫��Ӧ����д����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���۱���ϩ�������Ʊ���Ƶ��Ե���ϣ�����ϩ��һ�������´�������ͼת����ϵ��

��ش��������⣺
��1���ɱ���ϩ�ϳɸ߾���Ļ�ѧ����ʽΪ ��
��2��д��F�й����ŵ����ƣ�
��3��C���ܵĽṹ��ʽ�� ��
��4��H�ж���ͬ���칹�壬��д�������Ų���ȫ��ͬ������ͬ���칹��Ľṹ��ʽ��
��
��5����Ӧ���Ļ�ѧ����ʽ�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ֲ���纣���������к��зḻ�ĵ�Ԫ�أ���Ԫ���Ե����ӵ���ʽ���ڡ�ʵ������Ӻ�������ȡ����������£�

�� ����ȡ��Ĺ������й�ʵ��IJ������ƣ��� ���� ��д�����̢����йط�Ӧ�Ļ�ѧ����ʽ�� ��
����ȡ��Ĺ����У��ɹ�ѡ����л��Լ��� ��
A���ƾ� B���� C������ D�����Ȼ�̼
��Ϊʹ������е�����ת��Ϊ����л���Һ��ʵ���������ձ���������������ƿ���ƾ��ơ����ܡ�Բ����ƿ��ʯ�����Լ���Ҫ�ļг���������Ʒ����ȱ�ٵIJ��������� ��
�ȴӺ�����л���Һ����ȡ��ͻ����л��ܼ������辭������ָ����ͼ��ʾʵ��װ���еĴ���֮���� �� �� ��

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������ֻ���зǼ��Թ��ۼ������� ��
A��Cl2 B��NaOH C��KCl D��H2S
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��(12��)ij�л���Ľṹ��ʽΪHOOC��CH=CH-CH2OH��
�ش��������⣺
��1������д�����л��������еĹ����ŵ����ƣ� ��
��2����֤���л����к���-COOH�����ų����õķ��������� ��
��3��д�����л�������ˮ��Ӧ�Ļ�ѧ����ʽ�� ����Ӧ����Ϊ ��
��4�����л�������Ҵ�����������Ӧ��д���÷�Ӧ�ķ���ʽ�� ������д��������÷�Ӧ��Ӧ���ʵ�һ����ʩ: ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Դ�ɷ�Ϊһ����Դ�Ͷ�����Դ������������ȷ������ ��
A��ˮú����һ����Դ
B����Ȼ���Ƕ�����Դ
C�������Ƕ�����Դ
D��ˮ���Ƕ�����Դ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£����и�������һ������ָ����Һ�д���������ǣ� ��
A��ʹ��̪���ɫ����Һ�У�Na+��Al3+��SO42����Cl��
B��![]() ��1��10��13molL��1����Һ�У�NH4+��Ca2+��Cl����NO3��
��1��10��13molL��1����Һ�У�NH4+��Ca2+��Cl����NO3��
C����Al��Ӧ�ܷų�H2����Һ�У�Fe2+��K+��NO3����SO42��
D��ˮ�����c��H+��=1��10��13molL��1����Һ�У�K+��Na+��AlO2����CO32��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��I�����������л����У�
��CH4
��CH2��CH2
��![]()
��CH3COOH
��HOCH2CHO
��CH3CH2CH2CH3
��������
�൰����
�����
��1������Ũ���ᷢ����ɫ��Ӧ����______________������ţ���ͬ����
��2������ͬϵ����� ��
��3����Ϊͬ���칹�����___________��
��4������������Ӧ����______________��
II����5L���ܱ������г���1mol A ��2mol B����һ�������·�����Ӧ4A(g)+5B(g)![]() 4C(g)+6D(g)������Ӻ�C�����ʵ���������0.30mol��
4C(g)+6D(g)������Ӻ�C�����ʵ���������0.30mol��
��5��D��ƽ����Ӧ����Ϊ ��
��6��A��ת����Ϊ ��
��7�� �����жϸ÷�Ӧ�Ѵ�ƽ��״̬���� ��
A ����λʱ��������n mol A��ͬʱ����2n mol D��״̬
B ��������Ũ�Ȳ��ٱ仯��״̬
C ����������ƽ����Է����������ٸı��״̬
D ����������ѹǿ���ٸı��״̬
E�� �����и���ֵ������������ʱ��仯��״̬
F ��������A��B��C��D�����ʵ����ı�һ����4��5��4��6��״̬
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com