
����Ŀ��I����ͼ��ʾһЩ�����е�ijЩ�ṹ�����Ƿֱ����Ȼ��ơ��Ȼ�嵐��ɱ������ʯ��ʯī�ṹ�е�ijһ�ֵ�ijһ���֣��ڵ�ɱ�ʾ��ͬ����ͬ�����ӣ���
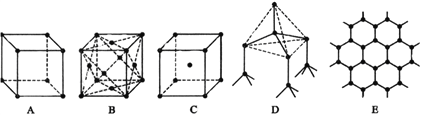
��1�����д������ʯ����_______��������ĸ����ͬ�������ʯ��ÿ��̼ԭ����_____��̼ԭ����ӽ��Ҿ�����ȡ�
��2�����д���ʯī����______������ÿ����������ռ�е�̼ԭ����ƽ��Ϊ____________����
��3�����б�ʾ�Ȼ��Ƶ���______��ÿ����������Χ������ӽ��Ҿ�����ȵ���������______����
��4�������Ȼ�蘆���________��ÿ���������________�������ӽ��ڣ�
II����1����֪14gCO��������������ȫȼ�տɷų�141.5 kJ��������д��COȼ�յ��Ȼ�ѧ����ʽ______________________________________________��
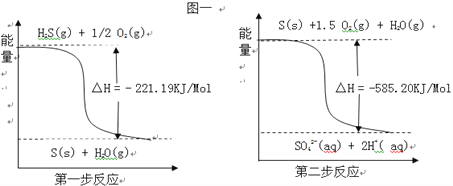
��2�������е�����ɽ�������H2S��������Ӧ������SO42����������Ӧ�������仯ʾ��ͼ���£���1mol H2S��g��ȫ��������SO42����aq�����Ȼ�ѧ����ʽΪ____________________________��
���𰸡� D 4 E 2 A 12 C 8 2CO(g) + O2(g) == 2CO2(g) ��H2 =��566.0 kJ��mol-1 H2S��g��+2O2��g��=SO42����aq��+2H+��aq����H=��806.39 kJmol��1
��������I�����⿼�鳣�����־���ľ�������1�����ʯ����ԭ�Ӿ��壬������������ʽ��������Ŀռ���״�ṹ����DΪ���ʯ�ṹ�����ʯ�����У�ÿ��̼ԭ�����ĸ����۵����ԳƵ������ڵ�4��̼ԭ�ӽ�ϣ���ÿ��̼ԭ����4��̼ԭ����ӽ��Ҿ�����ȣ���2��ʯī�Dz�״ƽ����Ԫ�����ṹ����BΪʯī�Ľṹ��ÿһ��̼ԭ�ӱ�3����Ԫ�����ã����ݾ�̯��������һ����Ԫ���ĵ�̼ԭ��ƽ��Ϊ6��1/3=2����3���Ȼ����������Ӿ��壬��ʾ�Ȼ��ƽṹ����A�������Ȼ��Ƶľ�������Na������Ҿ�����ȵ�������ͬ����4�����ϲ���4�����²���4�������������Ҿ�����ȵ�Na���ĸ���Ϊ12������4���Ȼ��Ϊ���Ӿ��壬Cs��λ�ھ����ڲ�����ʾ�Ȼ�綠ṹ����C��Cs��λ�����ģ�Cl��λ��8�����㣬���ÿ��Cs����8��Cl�����ڣ�II�����⿼���Ȼ�ѧ��Ӧ����ʽ����д����1��1molCOȼ��ʱ�ų�������Ϊ![]() kJ=283kJ�����COȼ�յ��Ȼ�ѧ��Ӧ����ʽΪCO(g)��1/2O2(g)=CO2(g) ��H=��2283kJ��mol��1��2CO(g)��O2(g)=2CO2(g) ��H=��566.0kJ��mol��1����2�����ø�˹���ɣ���Ӧ��ֻ��ʼ̬����̬�йأ��뷴Ӧ;���أ����H2S��g��+2O2��g��=SO42����aq��+2H+��aq����H=(��221.19��585.20)kJ��mol��1=��806.39 kJmol��1��
kJ=283kJ�����COȼ�յ��Ȼ�ѧ��Ӧ����ʽΪCO(g)��1/2O2(g)=CO2(g) ��H=��2283kJ��mol��1��2CO(g)��O2(g)=2CO2(g) ��H=��566.0kJ��mol��1����2�����ø�˹���ɣ���Ӧ��ֻ��ʼ̬����̬�йأ��뷴Ӧ;���أ����H2S��g��+2O2��g��=SO42����aq��+2H+��aq����H=(��221.19��585.20)kJ��mol��1=��806.39 kJmol��1��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����CH3CH3��CH3CH2Cl��CH2=CH2��CH3CH2OH��ת�������У������ķ�Ӧ�����ǣ� ��
A.ȡ�����ӳɡ�����
B.�ӳɡ�ȡ������ȥ
C.ȡ������ȥ���ӳ�
D.ȡ������ȥ��ˮ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ͬ�¡�ͬѹ�µ�������SO2�����CO2���壬�����йرȽϵ������У���ȷ���Ǣ��ܶȱ�Ϊ16��11 ���ܶȱ�Ϊ11��16 �������Ϊ16��11 �������Ϊ11��16�� ��
A.�٢�
B.�٢�
C.�ڢ�
D.�ڢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������Ԫ�����ڱ���Ԫ�������ɣ��ж�������������ȷ����
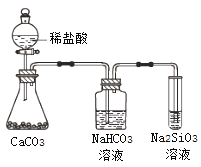
A. ��̬�⻯����ȶ��ԣ�H2O��NH3��SiH4
B. ��Ԫ��������Ԫ�ؿ��γɹ��ۻ���������ӻ�����
C. ��ͼ��ʾʵ���֤��Ԫ�صķǽ����ԣ�Cl��C��Si
D. ��������![]() ������o�������ĵ�118��Ԫ�������ڱ���λ�ڵ�������0��
������o�������ĵ�118��Ԫ�������ڱ���λ�ڵ�������0��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��A��B��C��D��E��F��ǰ������ԭ�������������������Ԫ����AԪ��ԭ�ӵĺ����������������Ӳ�����BԪ�ػ�̬ԭ���������ܼ��Ҹ��ܼ���������ͬ��A��D���γ����ֳ���Һ̬������G��H����ԭ����֮�ȷֱ�Ϊ1:1��2:1��EԪ��ԭ�ӵ�K��L�������֮�͵�����M��N�������֮�ͣ�F����Ϊ��������֮��ĵ����������������õ��������ԣ�������������ɻ���������������ǡ�����ɴ���������F4+���ԭ�ӵĺ�������Ų���ͬ����ش����и��⣨�漰Ԫ��������Ӧ��ѧ���ű�ʾ����
��1��B��C��D�е縺������Ԫ�����̬ԭ����________�ֲ�ͬ�����ĵ��ӡ�
��2��G������Dԭ�ӵ��ӻ���ʽΪ_____________��F2+�Ļ�̬�۵����Ų�ʽΪ____________��
��3��BA3- ���ӵĿռ乹��Ϊ________�����以Ϊ�ȵ������һ�������ӵĵ���ʽΪ____________��
��4��ij�����ᄃ���ṹ����ͼ��ʾ��E2+������ҵȾ��D2-��_________����KIO3������һ���������õķ����Թ�ѧ���ϣ���������ͼ���Ƶ�����ṹ���߳�Ϊa=0.446nm��������K��I��O�ֱ��ڶ��ǡ����ġ�����λ�ã�K��O�����̾���Ϊ______nm��

��5���ø�����������Һ̬Hʱ��һ��H�������ͷų�һ�����ӣ�ͬʱ����һ�������ӡ��ͷų����ĵ��ӿ��Ա�����H�����γɵ���������������ΪH���Ӽ����γ���������ԭ��________________������H�����ͷų�����ʱ�����ĸ��������Ӿ��н�ǿ�������ԣ���д������������S02��ˮ��Һ��Ӧ���ӷ���ʽ______________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������������л�����ȫȼ��ʱ�����������ǣ� ��
A.C2H6
B.C3H4
C.C6H6
D.C2H4
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��X��Y��Z��P��QΪ���ֶ�����Ԫ��,��ԭ�Ӱ뾶������������֮��Ĺ�ϵ����ͼ��ʾ������˵����ȷ����

A. Q��������һ���������Ӽ����ۼ� B. ��ۺ����������:Z<Y
C. P����ͼ��⻯�ﳣ�³�ѹ��ΪҺ�� D. Y�γɵĻ������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ�������N2��O2��CO2�������ͨ��������Na2O2��ͬ��ͬѹ�������Ϊԭ����0.75����ԭ���������N2��O2��CO2���ʵ���֮�ȿ���Ϊ
A.1��1��2B.4��3��5C.1��2��1D.6��7��14
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и������ʻ�Ϻ��ټ������ɲ�����������������䣬���ղ���һ���Ǵ�������ǣ� ��
A. ��Na[Al (OH )4]��Һ�м������������
B. ��KI��KBr ��Һ��ͨ������Cl2
C. ��FeSO4��Һ�м���������NaOH ��Һ
D. ��NaHCO3 ��Һ�м���Na2O2 ��ĩ
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com