
【题目】A、B、C、D、E、F是前四周期原子序数依次增大的六种元素。A元素原子的核外电子数等于其电子层数,B元素基态原子有三个能级且各能级电子数相同,A与D可形成两种常见液态化合物G、H,其原子数之比分别为1:1和2:1,E元素原子的K、L层电子数之和等于其M、N层电子数之和,F被称为继铁、铝之后的第三金属,具有良好的生物亲和性,还可用于制造飞机、火箭、人造卫星、宇宙飞船等领域,F4+和氩原子的核外电子排布相同。请回答下列各题(涉及元素请用相应化学符号表示):
(1)B、C、D中电负性最大的元素其基态原子有________种不同能量的电子。
(2)G分子中D原子的杂化方式为_____________,F2+的基态价电子排布式为____________。
(3)BA3- 离子的空间构型为________,与其互为等电子体的一种阳离子的电子式为____________。
(4)某化合物晶胞结构如右图所示,E2+的最近且等距的D2-有_________个。KIO3晶体是一种性能良好的非线性光学材料,具有与右图相似的立体结构,边长为a=0.446nm,晶胞中K、I、O分别处于顶角、体心、面心位置,K与O间的最短距离为______nm。

(5)用高能射线照射液态H时,一个H分子能释放出一个电子,同时产生一种阳离子。释放出来的电子可以被若干H分子形成的“网”捕获,你认为H分子间能形成“网”的原因________________。且由H分子释放出电子时产生的该种阳离子具有较强的氧化性,试写出该阳离子与S02的水溶液反应离子方程式______________________________;
【答案】 3 sp3 3d2 三角锥形 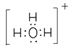 6 0.315(或0.223
6 0.315(或0.223![]() ) 水分子间存在氢键 2H2O+ + SO2 = 4H+ + SO42—
) 水分子间存在氢键 2H2O+ + SO2 = 4H+ + SO42—
【解析】(1)本题考查电负性规律、能级,A元素原子的核外电子数等于其电子层数,推出A为H,B元素基态原子有三个能级且各能级电子数相同,电子排布式为1s22s22p2,即B为C,A与D可形成两种常见液态化合物G、H,其原子数之比分别为1:1和2:1,则D为O,G为H2O2,H为H2O,因为原子序数依次增大,因此C为N,E元素原子的K、L层电子数之和等于其M、N层电子数之和,E为Ca,F被称为继铁、铝之后的第三金属,具有良好的生物亲和性,还可用于制造飞机、火箭、人造卫星、宇宙飞船等领域,F4+和氩原子的核外电子排布相同,推出F为Ti,B、C、D中电负性最大的是O,电子排布式为1s22s22p4,有3种能量不同的电子;(2)考查杂化类型的判断,G为H2O2,其结构式为H-O-O-H,O的价层电子对数为2+2=4,杂化轨道数等于价层电子对数,即H2O2中O的杂化类型为sp3;Ti2+的基态价电子应是次外层d能级,即为3d2;(3)考查空间构型、等电子体,BA3-为CH3-,C的价层电子对数为3+(4+1-3)/2=4,空间构型为三角锥形;与CH3-互为等电子体的阳离子为H3O+,其电子式为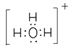 ;(4)考查晶胞,根据晶胞的结构,Ca2+的最近且等距的O2-有6个;K与O最近的距离是面对角线的一半,即为
;(4)考查晶胞,根据晶胞的结构,Ca2+的最近且等距的O2-有6个;K与O最近的距离是面对角线的一半,即为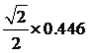 nm=0.223
nm=0.223![]() nm;(5)本题考查氢键和离子反应方程式的书写,H2O分子释放出一个电子,同时产生一种阳离子,即阳离子是H2O+,H2O分子间能够构成氢键,形成“网”的原因是水分子间存在氢键,H2O+具有强氧化性,SO2具有强还原性,H2O+把SO2氧化成H2SO4,因此离子反应方程式为:2H2O+ + SO2 = 4H+ + SO42-。
nm;(5)本题考查氢键和离子反应方程式的书写,H2O分子释放出一个电子,同时产生一种阳离子,即阳离子是H2O+,H2O分子间能够构成氢键,形成“网”的原因是水分子间存在氢键,H2O+具有强氧化性,SO2具有强还原性,H2O+把SO2氧化成H2SO4,因此离子反应方程式为:2H2O+ + SO2 = 4H+ + SO42-。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】A,B,C,D 4种元素,A元素所处的周期数、主族序数、原子序数均相等;B的原子半径是其所在主族中最小的,B的最高价氧化物对应水化物的化学式为HBO3;C元素原子的最外层电子数比次外层少2个;C的阴离子与D的阳离子具有相同的电子排布,两元素可形成化合物D2C.
(1)B元素的名称为;
(2)A,B形成的化合物的电子式为 .
(3)C的元素符号为 , C的最高价氧化物的化学式为 .
(4)D的最高价氧化物对应的水化物的化学式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列金属或氧化物可以完全溶解的是
A、1molZn与含1molHCl的稀盐酸共热
B、1molCu与含2molH2SO4的浓硫酸共热
C、1molCu与含4molHNO3的浓硝酸
D、1molMnO2与含4molHCl的浓盐酸共热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碘是人类必需的生命元素,在人体的生长发育过程中起着重要作用,实验小组进行碘单质的制备。
【查阅资料】碱性条件下,I2会发生歧化反应生成I-和IO3-,酸性条件下, I-和IO3-又会发生归中反应生成I2;碘在水中的溶解度为0.029g。
【碘的制取】以海带为原料,按照以下步骤进行实验。

(1)将海带灼烧成灰后再用水浸取,目的是_______________。
(2)步骤B发生的反应是“氧化”,这一操作中可供选用的试剂: ①Cl2;②Br2;③稀硫酸和H2O2,从无污染角度考虑,你认为合适试剂是______(填编号),反应中I-转化为I2 的离子反应方程式为_______________。
(3)步骤C中使用的起到分离作用的仪器是_____________,使用该仪器时,第一步操作是_______________。
(4)有同学查资料后发现CCl4有毒,提议用乙醇代替,请判断该提议是否可行,原因是_______________。
【碘的分离】得到含I2的CCl4溶液后,利用右图装置进行碘的提取并回收溶剂。

(5)图中有两处明显错误,分别是①_________;②_________。
(6)对实验装置的错误改正之后进行分离操作。预期锥形瓶中得到无色的CCl4,实验结果锥形瓶中得到紫红色液体,请分析出现该实验结果的原因____________,为了保证实验成功,请提出改进方案:___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I、下图表示一些晶体中的某些结构,它们分别是氯化钠、氯化铯、干冰、金刚石、石墨结构中的某一种的某一部分(黑点可表示不同或相同的粒子)。
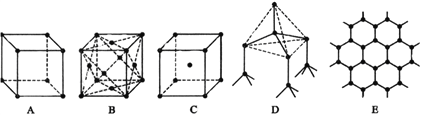
(1)其中代表金刚石的是_______(填编号字母,下同),金刚石中每个碳原子与_____个碳原子最接近且距离相等。
(2)其中代表石墨的是______,其中每个正六边形占有的碳原子数平均为____________个;
(3)其中表示氯化钠的是______,每个钠离子周围与它最接近且距离相等的钠离子有______个;
(4)代表氯化铯的是________,每个铯离子与________个氯离子紧邻;
II、(1)已知14gCO气体在氧气中完全燃烧可放出141.5 kJ的热量,写出CO燃烧的热化学方程式______________________________________________;
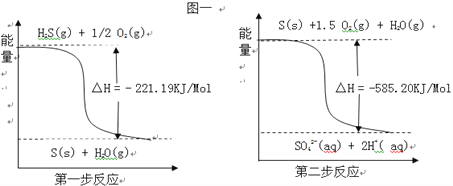
(2)土壤中的微生物可将大气中H2S经两步反应氧化成SO42﹣,两步反应的能量变化示意图如下:则1mol H2S(g)全部氧化成SO42﹣(aq)的热化学方程式为____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阅读明代爱国诗人于谦的诗《石灰吟》,回答问题: 千锤万凿出深山,烈火焚烧若等闲.粉身碎骨浑不怕,要留清白在人间
(1)整首诗蕴含着石灰的来源、生产、性质、用途等多种化学事实,诗中所描述的变化共涉及到下列物质:①石灰石(主要成分CaCO3)②CaO③CO2④H2O⑤Ca(OH)2悬浊液⑥CaCO3 , 其中属于电解质的是(填序号)
(2)下列工业生产中一般不用石灰石作为原料的是(填序号) ①用海水为原料生产镁 ②制硅酸盐水泥 ③制普通玻璃 ④制漂白粉⑤制陶瓷
(3)零食包装袋中经常有一个小纸袋,上面写着“干燥剂”,其主要成分是生石灰,生石灰属于氧化物(填“酸性”或“碱性”),用方程式说明你的理由 .
(4)某兴趣小组同学对碳酸钙的制备进行了以下探究,该组同学使用大理石(含少量的Fe2O3杂质)等物质制备碳酸钙的实验流程如图: 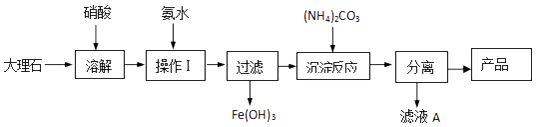 溶解大理石时,用硝酸而不用硫酸的原因是 , “滤液A”中除H+离子外,还含有的阳离子是;检验该阳离予的实验操作是 .
溶解大理石时,用硝酸而不用硫酸的原因是 , “滤液A”中除H+离子外,还含有的阳离子是;检验该阳离予的实验操作是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 合金一定是金属熔合而成的物质
B. 利用丁达尔效应可以鉴别Fe(OH)3胶体和FeCl3溶液
C. 当大量氯气泄漏时,用NaOH溶液浸湿毛巾捂住嘴和鼻子,并迅速离开现场
D. 实验室常将氢氟酸保存在细口玻璃瓶
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有反应:mA(g)+nB(g)![]() pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数也减小,则:
pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数也减小,则:
(1)该反应的逆反应为_________热反应,且m+n_________p(填“>”“=”“<”)。
(2)减压时,A的质量分数_________。(填“增大”“减小”或“不变”,下同)
(3)若加入B(体积不变),则A的转化率_________,B的转化率_________。
(4)若升高温度,则平衡时B、C的浓度之比 将_________。
(5)若B是有色物质,A、C均无色,则加入C(体积不变)时混合物颜色_______,而维持容器内压强不变,充入氖气时,混合物颜色_______(填“变深”“变浅”或“不变”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com