
【题目】现有反应:mA(g)+nB(g)![]() pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数也减小,则:
pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数也减小,则:
(1)该反应的逆反应为_________热反应,且m+n_________p(填“>”“=”“<”)。
(2)减压时,A的质量分数_________。(填“增大”“减小”或“不变”,下同)
(3)若加入B(体积不变),则A的转化率_________,B的转化率_________。
(4)若升高温度,则平衡时B、C的浓度之比 将_________。
(5)若B是有色物质,A、C均无色,则加入C(体积不变)时混合物颜色_______,而维持容器内压强不变,充入氖气时,混合物颜色_______(填“变深”“变浅”或“不变”)。
【答案】 放 > 增大 增大 减小 减小 变深 变浅
【解析】(1)升高温度时,B的转化率变大,则升高温度平衡正向移动,该反应为吸热反应;减小压强时,混合体系中C的质量分数也减小,则减小压强平衡逆向移动,则m+n>p;
(2)减压时,平衡逆向移动,则反应物A的质量分数增大;
(3)在反应容器中加入一定量的B,反应物B的浓度增大,平衡向正反应方向移动,则A的转化率增大,因B加入的多,而转化的少,则B的转化率反而减小;
(4)正反应是吸热反应,则升高温度平衡向正反应方向移动,B的物质的量减小,C的物质的量增多,所以二者的比值将减小;
(5)若B是有色物质,A、C均无色,则加入C平衡向逆反应方向移动,B的浓度增大,则颜色加深;而维持容器内压强不变,充入氖气时,体积增大,对于反应体系来说,相当于减小压强,则平衡向逆反应方向移动,但移动的量远小于体积增大的因素,则B的浓度减小,颜色变浅。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F是前四周期原子序数依次增大的六种元素。A元素原子的核外电子数等于其电子层数,B元素基态原子有三个能级且各能级电子数相同,A与D可形成两种常见液态化合物G、H,其原子数之比分别为1:1和2:1,E元素原子的K、L层电子数之和等于其M、N层电子数之和,F被称为继铁、铝之后的第三金属,具有良好的生物亲和性,还可用于制造飞机、火箭、人造卫星、宇宙飞船等领域,F4+和氩原子的核外电子排布相同。请回答下列各题(涉及元素请用相应化学符号表示):
(1)B、C、D中电负性最大的元素其基态原子有________种不同能量的电子。
(2)G分子中D原子的杂化方式为_____________,F2+的基态价电子排布式为____________。
(3)BA3- 离子的空间构型为________,与其互为等电子体的一种阳离子的电子式为____________。
(4)某化合物晶胞结构如右图所示,E2+的最近且等距的D2-有_________个。KIO3晶体是一种性能良好的非线性光学材料,具有与右图相似的立体结构,边长为a=0.446nm,晶胞中K、I、O分别处于顶角、体心、面心位置,K与O间的最短距离为______nm。

(5)用高能射线照射液态H时,一个H分子能释放出一个电子,同时产生一种阳离子。释放出来的电子可以被若干H分子形成的“网”捕获,你认为H分子间能形成“网”的原因________________。且由H分子释放出电子时产生的该种阳离子具有较强的氧化性,试写出该阳离子与S02的水溶液反应离子方程式______________________________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,苯甲酸可实现如下转化:

(1)Mn2+基态核外电子排布式为________。
(2)B、C、O、K 的第一电离能由小到大的顺序是________。
(3)1mol苯甲酸分子含有δ键的数目为________,苯甲醇分子中O原子的轨道杂化类型为____。
(4)KBH4中所含BH4-离子空间构型为_____,写出一种与BH4-互为等电子体的阳离子的化学式:_________。
(5)苯甲酸、苯甲醛、苯甲醇三种物质中沸点最低的是____,原因是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,将H2和N2置于一容积为2 L的密闭容器中发生反应。反应过程中H2、N2和NH3的物质的量变化如下图:
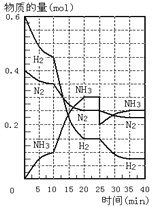
(1)计算反应开始10分钟内,NH3的平均反应速率___________
(2)反应处于平衡状态的时间是:__________________________
(3)图中10~20分钟曲线发生变化的可能原因是_______________。
(4)第25分钟,平衡改变的条件是____________________,此时正反应速率_____(填增大、减小或不变),重新达平衡后,NH3的体积分数比原平衡______(填大、小或不变)。
(5)判断该反应达到平衡状态的标志是_________________________(填字母);
a.N2和NH3浓度相等 b.NH3百分含量保持不变
c.容器中气体的压强不变 d.NH3的生成速率与H2的消耗速率相等
e.容器中混合气体的密度保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据研究,若把太阳光变成激光用于分解海水制氢,反应可表示为:2H2O ![]() H2↑+O2↑.有下列几种说法: ①水分解反应是放热反应;
H2↑+O2↑.有下列几种说法: ①水分解反应是放热反应;
②氢气是可再生能源;
③使用氢气作燃料有助于控制温室效应;
④若用生成的氢气与空气中多余的二氧化碳反应生成甲醇储存起来,可改善生存条件.其中叙述正确的是( )
A.①②
B.③④
C.②③④
D.①②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质混合后,再加热蒸干并充分灼烧至质量不变,最终产物一定是纯净物的是( )
A. 向Na[Al (OH )4]溶液中加入过量的盐酸
B. 向KI和KBr 溶液中通入足量Cl2
C. 向FeSO4溶液中加入足量的NaOH 溶液
D. 向NaHCO3 溶液中加入Na2O2 粉末
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(6分)将4molSO2与2molO2放入4L的密闭容器中,在一定条件下反应达到平衡:2SO2(g)+O2(g)![]() 2SO3(g) ,测得平衡时混合物总的物质的量为5mol,求:
2SO3(g) ,测得平衡时混合物总的物质的量为5mol,求:
(1)平衡时SO3的浓度;
(2)该温度下的平衡常数;
(3)平衡时SO2的转化率。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E都为短周期元素,A是相对原子质量最小的元素;B的+1价阳离子和C的﹣1价阴离子都与氖原子具有相同昀电子层结构;D在C的下一周期,可与 B形成BD型离子化合物;E和C为同一周期元素,其最高价氧化物对应的水化物为一种强酸.请根据以上信息回答下列问题.
(1)B元素在元素周期表中的位置 .
(2)画出D元素的原子结构示意图 .
(3)与E的氢化物分子所含电子总数相等的分子是(举一例、填化学式,下同)、离子是 .
(4)A与C形成的化合物中含有化学键的类型是 .
(5)D的单质与B的最髙价氧化物对应的水化物的溶液发生反应的离子方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列过程中,最终的白色沉淀不一定是BaSO4的是( )
A.Ba(NO3)2溶液 ![]() 白色沉淀
白色沉淀
B.无色溶液 ![]()
![]() 白色沉淀
白色沉淀
C.Ba(NO3)2溶液 ![]() 无现象
无现象 ![]() 白色沉淀
白色沉淀
D.Fe(NO3)2溶液 ![]()
![]()
![]() 白色沉淀
白色沉淀
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com