
����Ŀ��һ�������£��������ʵ������ת��:

��1��Mn2+��̬��������Ų�ʽΪ________��
��2��B��C��O��K �ĵ�һ��������С�����˳����________��
��3��1mol��������Ӻ�����������ĿΪ________�����״�������Oԭ�ӵĹ���ӻ�����Ϊ____��
��4��KBH4������BH4-���ӿռ乹��Ϊ_____,д��һ����BH4-��Ϊ�ȵ�����������ӵĻ�ѧʽ:_________��
��5�������ᡢ����ȩ�����״����������зе���͵���____��ԭ����_____________��
���𰸡� ls22s22p63s23p63d5����[Ar]3d5�� K��B��C��O 15 mol sp3 ���������� NH4+ ����ȩ ����ȩ���Ӽ䲻��������������������ʷ��Ӽ�������
��������(1)����25��Ԫ�أ�Mn2+��̬��������Ų�ʽΪls22s22p63s23p63d5���ʴ�Ϊ��ls22s22p63s23p63d5��
(2)ͬ���ڣ���һ��Ԫ�صĵ�һ��������С�����һ��Ԫ�صĵ�һ���������������ִ�������������ı仯���ơ�ͬ��Ԫ�أ��������µ�һ��������С������Χ������������ȵĹ�����γ�ȫ��(p0��d0��f0)������(p3��d5��f7)��ȫ��(p6��d10��f14)�ṹʱ��ԭ�ӵ������ϵͣ�Ԫ�صĵ�һ�����ܽϴ�B��C��O��K�ĵ�һ��������С�����˳��ΪK��B��C��O���ʴ�Ϊ��K��B��C��O��
(3)1mol����������к���5molC-H��7molC-C��1molC=O��1molC-O��1molO-H������������15mol�����״�������Oԭ������2��ԭ�ӣ���2���µ��Ӷԣ�����sp3�ӻ����ʴ�Ϊ��15 mol��sp3��
(4)KBH4������BH4-������Bԭ�Ӳ���sp3�ӻ����ռ乹��Ϊ���������Σ���BH4-��Ϊ�ȵ������������ΪNH4+���ʴ�Ϊ�����������Σ�NH4+��
(5)����ȩ���Ӽ䲻��������������������ʷ��Ӽ������������Ӽ�����ܹ�ʹ���ʵķе����ߣ����ᡢ����ȩ�����״����������зе���͵��DZ���ȩ���ʴ�Ϊ������ȩ������ȩ���Ӽ䲻��������������������ʷ��Ӽ���������



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������л����������ȷ���ǣ� ��
A.3��3����������
B.3������2���һ�����
C.1��1��������ϩ
D.2��3��������ϩ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ķ���������ʫ����ǫ��ʫ��ʯ���������ش����⣺ ǧ���������ɽ���һ���������У�������ǻ벻�£�Ҫ��������˼�
��1������ʫ�̺���ʯ�ҵ���Դ�����������ʡ���;�ȶ��ֻ�ѧ��ʵ��ʫ���������ı仯���漰���������ʣ���ʯ��ʯ����Ҫ�ɷ�CaCO3����CaO��CO2��H2O��Ca��OH��2����Һ��CaCO3 �� �������ڵ���ʵ���������ţ�
��2�����й�ҵ������һ�㲻��ʯ��ʯ��Ϊԭ�ϵ���������ţ� ���ú�ˮΪԭ������þ ���ƹ�����ˮ�� ������ͨ���� ����Ư�ۢ����մ�
��3����ʳ��װ���о�����һ��Сֽ��������д�š��������������Ҫ�ɷ�����ʯ�ң���ʯ���������������ԡ����ԡ������÷���ʽ˵��������� ��
��4��ij��ȤС��ͬѧ��̼��Ƶ��Ʊ�����������̽��������ͬѧʹ�ô���ʯ����������Fe2O3���ʣ��������Ʊ�̼��Ƶ�ʵ��������ͼ�� 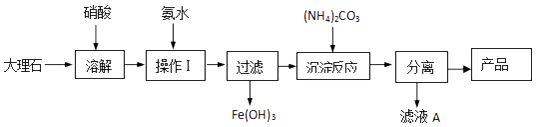 �ܽ����ʯʱ������������������ԭ���� �� ����ҺA���г�H+�����⣬�����е�����������������������ʵ������� ��
�ܽ����ʯʱ������������������ԭ���� �� ����ҺA���г�H+�����⣬�����е�����������������������ʵ������� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ����
A. �Ͻ�һ���ǽ����ۺ϶��ɵ�����
B. ���ö����ЧӦ���Լ���Fe(OH)3�����FeCl3��Һ
C. ����������й©ʱ����NaOH��Һ��ʪë����ס��ͱ��ӣ���Ѹ���뿪�ֳ�
D. ʵ���ҳ�������ᱣ����ϸ�ڲ���ƿ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з����У�����������Ϊ24����
A. 18O3 B. 2H217O2 C. 14N16O2 D. 14C16O2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������ɱ���ܱ������о�����1mol��A ��2 mol ��B,������Ӧ:A2(g)+2B2(g)![]() 2AB2(g) ��H��ά������������ѹǿ�ֱ�Ϊp1��p2,�ڲ�ͬ�¶��´ﵽƽ�⣬���ƽ��ʱAB2������������¶ȵı仯��ͼ��ʾ��
2AB2(g) ��H��ά������������ѹǿ�ֱ�Ϊp1��p2,�ڲ�ͬ�¶��´ﵽƽ�⣬���ƽ��ʱAB2������������¶ȵı仯��ͼ��ʾ��
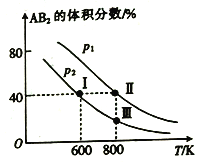
��֪: ��ͼ��I��������������������ϣ��ڵ���ʱ���������Ϊ0.1L������������ȷ����
A. ��ͼ���֪:p1>p2 ��H<0
B. ��IʱA2��ƽ��ת����Ϊ40%
C. ��������Ӧ�ķ�Ӧƽ�ⳣ��K=0.2
D. ����������Ӧ��������ȴ��600 K,�ɱ�ɵ�I
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ���¶��£��� 5L ���ܱ������з������·�Ӧ��N2 ��g��+3H2 ��g��2NH3��g������������ 3.0mol N2 �� 6.0mol H2 �� 5 ���Ӻ�ﵽƽ�⣬��ʱ������ѹǿ�ǿ�ʼʱ�� ![]() ���ʣ�
���ʣ�
��1��������ƽ��ת����Ϊ��
��2���ð�����ʾ 5min �ڵķ�Ӧ����Ϊ
��3����Ҫʹ������������ƽ��ת������ȣ���ʼͶ��Ҫ�� n��H2 ����n��N2 ��Ϊ
��4�����´�ʩ�ܼӿ췴Ӧ���ʵ���
A.��С�����ʹѹǿ����
B.���º��ݳ��� He ʹѹǿ����
C.���º�ѹ���� He
D.ƽ���������
��5��������ô˷�Ӧ��Ƴ�ԭ��أ�����ϡ���������Һ���ֱ�д�����������ĵ缫��Ӧ ʽ���� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з�Ӧ��mA(g)+nB(g)![]() pC(g)���ﵽƽ��������¶�ʱ��B��ת���ʱ����Сѹǿʱ�������ϵ��C����������Ҳ��С����:
pC(g)���ﵽƽ��������¶�ʱ��B��ת���ʱ����Сѹǿʱ�������ϵ��C����������Ҳ��С����:
��1���÷�Ӧ���淴ӦΪ_________�ȷ�Ӧ����m+n_________p(����������=��������)��
��2����ѹʱ��A����������_________��(��������������С����������������ͬ)
��3��������B(�������)����A��ת����_________��B��ת����_________��
��4���������¶ȣ���ƽ��ʱB��C��Ũ��֮�� ��_________��
��5����B����ɫ���ʣ�A��C����ɫ�������C(�������)ʱ�������ɫ_______����ά��������ѹǿ���䣬��������ʱ���������ɫ_______(��������������dz������������)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ijͬѧΪ̽��Ԫ�����ڱ���ͬ����Ԫ�����ʵĵݱ���ɣ����������ϵ��ʵ�飮
��1�����ơ�þ������1mol�ֱ�Ͷ�뵽������ͬŨ�ȵ������У���Ԥ��ʵ�����������ᷴӦ����ң������ᷴӦ������������࣮
��2����Na2S��Һ��ͨ���������ֻ�ɫ���ǣ���֤��Cl�ķǽ����Ա�Sǿ����Ӧ�����ӷ���ʽΪ ��
��3�������D�������� ��
��4����Ҫ֤���ǽ����ԣ�Cl��I����A�м�Ũ���ᣬB�м�KMnO4 �� ��KMnO4��Ũ���᳣���·�Ӧ������������C�мӵ��۵⻯�ػ����Һ���۲쵽C����Һ��������֤�����ӻ��������Ĺ۵㿼�ǣ���װ��ȱ��β������װ�ã�������Һ����β����
��5����Ҫ֤���ǽ����ԣ�C��Si������A�м����ᡢB�м�CaCO3��C�м�Na2SiO3��Һ���۲쵽C����Һ��������֤�������е�ͬѧ��Ϊ������лӷ��ԣ��ɽ���C�и���ʵ�飬Ӧ����װ�ü�����װ����Һ��ϴ��ƿ�� 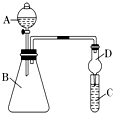
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com