
【题目】下列有机物的命名正确的是( )
A.3,3﹣二甲基丁烷
B.3﹣甲基﹣2﹣乙基戊烷
C.1,1﹣二氯乙烯
D.2,3﹣二甲基戊烯
 全优点练单元计划系列答案
全优点练单元计划系列答案科目:高中化学 来源: 题型:
【题目】在锌与盐酸反应的实验中,一个学生得到的结果如下表所示:
编号 | 锌的质量/g | 锌的形状 | 温度/℃ | 完全溶解 |
A | 2 | 薄片 | 5 | 400 |
B | 2 | 薄片 | 15 | 200 |
C | 2 | 薄片 | 25 | 100 |
D | 2 | 薄片 | 35 | t1 |
E | 2 | 细小颗粒 | 15 | t2 |
F | 2 | 粉末 | 15 | t3 |
G | 2 | 薄片(含少量杂质Cu) | 35 | t4 |
(1)t1=s,画出以时间对温度的曲线图(纵轴表示时间,横轴表示温度). 
(2)利用所画的曲线图,总结并得出的关于温度影响反应速率的结论是;
(3)t1t4(填“>”或“<”),原因是 . t2t3(填“>”或“<”),原因是;
(4)单位时间内消耗锌的质量mB、mE、mF从大到小的顺序为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在C(s)+CO2(g)=2CO(g)的反应中,现采取下列措施:①缩小体积,增大压强②增加碳的量③通入CO2④恒容下充入N2⑤恒压下充入N2。其中能够使反应速率增大的措施是
A. ①④ B. ②③⑤ C. ①③ D. ①②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】重金属元素铬的毒性较大,含铬废水需经处理达标后才能排放。
(Ⅰ)某工业废水中主要含有Cr3+,同时还含有少量的Fe2+、Fe3+、Al3+、Ca2+和Mg2+等,且酸性较强。为回收利用,通常采用如下流程处理:
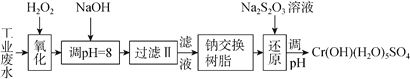
注:部分阳离子常温下以氢氧化物形式完全沉淀时溶液的pH见下表。
氢氧化物 | Fe(OH)3 | Fe(OH)2 | Mg(OH)2 | Al(OH)3 | Cr(OH)3 |
pH | 3.7 | 9.6 | 11.1 | 8 | 9(>9溶解) |
(1)氧化过程中可代替H2O2加入的试剂是________(填序号)。
A.Na2O2 B.HNO3 C.FeCl3 D.KMnO4
(2)加入NaOH溶液调整溶液pH=8时,除去的离子是___(填序号);已知钠离子交换树脂的原理:Mn++nNaRMRn+nNa+,此步操作被交换除去的杂质离子___(填序号)。
A.Fe3+ B.Al3+ C.Ca2+ D.Mg2+
(3)在还原过程中,每消耗172.8gCr2O72- 转移4.8mole-,则还原过程中该反应离子方程式为____。(已知在氧化过程中Cr3+转化为Cr2O72- )
(Ⅱ)酸性条件下,铬元素主要以Cr2O72-形式存在,工业上常用电解法处理含Cr2O72-的废水。实验室利用如图装置模拟处理该废水,阳极反应是Fe-2e-![]() Fe2+,阴极反应式是2H++2e-
Fe2+,阴极反应式是2H++2e-![]() H2↑。
H2↑。
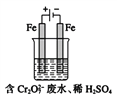
(1)电解时能否用Cu电极来代替Fe电极?______(填“能”或“不能”),理由是_____。
(2)电解时阳极附近溶液中转化为Cr3+的离子方程式为___________________。
(3)上述反应得到的金属阳离子在阴极区可沉淀完全,从其对水的电离平衡影响角度解释其原因______________________。
(4)若溶液中初始含有0.1mol Cr2O72-,则生成的阳离子全部转化成沉淀的质量是_______g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某烃1mol 最多能和2molHBr 加成反应,其所得的产物又能跟8molBr2 发生取代反应,最后得到一种只含碳、溴两种元素的化合物,则原烃为( )
A.C4H6
B.C3H4
C.C3H6
D.C2H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】同温、同压下等质量的SO2气体和CO2气体,下列有关比较的叙述中,正确的是①密度比为16:11 ②密度比为11:16 ③体积比为16:11 ④体积比为11:16( )
A.①③
B.①④
C.②③
D.②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F是前四周期原子序数依次增大的六种元素。A元素原子的核外电子数等于其电子层数,B元素基态原子有三个能级且各能级电子数相同,A与D可形成两种常见液态化合物G、H,其原子数之比分别为1:1和2:1,E元素原子的K、L层电子数之和等于其M、N层电子数之和,F被称为继铁、铝之后的第三金属,具有良好的生物亲和性,还可用于制造飞机、火箭、人造卫星、宇宙飞船等领域,F4+和氩原子的核外电子排布相同。请回答下列各题(涉及元素请用相应化学符号表示):
(1)B、C、D中电负性最大的元素其基态原子有________种不同能量的电子。
(2)G分子中D原子的杂化方式为_____________,F2+的基态价电子排布式为____________。
(3)BA3- 离子的空间构型为________,与其互为等电子体的一种阳离子的电子式为____________。
(4)某化合物晶胞结构如右图所示,E2+的最近且等距的D2-有_________个。KIO3晶体是一种性能良好的非线性光学材料,具有与右图相似的立体结构,边长为a=0.446nm,晶胞中K、I、O分别处于顶角、体心、面心位置,K与O间的最短距离为______nm。

(5)用高能射线照射液态H时,一个H分子能释放出一个电子,同时产生一种阳离子。释放出来的电子可以被若干H分子形成的“网”捕获,你认为H分子间能形成“网”的原因________________。且由H分子释放出电子时产生的该种阳离子具有较强的氧化性,试写出该阳离子与S02的水溶液反应离子方程式______________________________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,苯甲酸可实现如下转化:

(1)Mn2+基态核外电子排布式为________。
(2)B、C、O、K 的第一电离能由小到大的顺序是________。
(3)1mol苯甲酸分子含有δ键的数目为________,苯甲醇分子中O原子的轨道杂化类型为____。
(4)KBH4中所含BH4-离子空间构型为_____,写出一种与BH4-互为等电子体的阳离子的化学式:_________。
(5)苯甲酸、苯甲醛、苯甲醇三种物质中沸点最低的是____,原因是_____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com