
【题目】下列金属或氧化物可以完全溶解的是
A、1molZn与含1molHCl的稀盐酸共热
B、1molCu与含2molH2SO4的浓硫酸共热
C、1molCu与含4molHNO3的浓硝酸
D、1molMnO2与含4molHCl的浓盐酸共热
科目:高中化学 来源: 题型:
【题目】重金属元素铬的毒性较大,含铬废水需经处理达标后才能排放。
(Ⅰ)某工业废水中主要含有Cr3+,同时还含有少量的Fe2+、Fe3+、Al3+、Ca2+和Mg2+等,且酸性较强。为回收利用,通常采用如下流程处理:
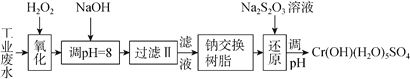
注:部分阳离子常温下以氢氧化物形式完全沉淀时溶液的pH见下表。
氢氧化物 | Fe(OH)3 | Fe(OH)2 | Mg(OH)2 | Al(OH)3 | Cr(OH)3 |
pH | 3.7 | 9.6 | 11.1 | 8 | 9(>9溶解) |
(1)氧化过程中可代替H2O2加入的试剂是________(填序号)。
A.Na2O2 B.HNO3 C.FeCl3 D.KMnO4
(2)加入NaOH溶液调整溶液pH=8时,除去的离子是___(填序号);已知钠离子交换树脂的原理:Mn++nNaRMRn+nNa+,此步操作被交换除去的杂质离子___(填序号)。
A.Fe3+ B.Al3+ C.Ca2+ D.Mg2+
(3)在还原过程中,每消耗172.8gCr2O72- 转移4.8mole-,则还原过程中该反应离子方程式为____。(已知在氧化过程中Cr3+转化为Cr2O72- )
(Ⅱ)酸性条件下,铬元素主要以Cr2O72-形式存在,工业上常用电解法处理含Cr2O72-的废水。实验室利用如图装置模拟处理该废水,阳极反应是Fe-2e-![]() Fe2+,阴极反应式是2H++2e-
Fe2+,阴极反应式是2H++2e-![]() H2↑。
H2↑。
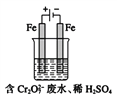
(1)电解时能否用Cu电极来代替Fe电极?______(填“能”或“不能”),理由是_____。
(2)电解时阳极附近溶液中转化为Cr3+的离子方程式为___________________。
(3)上述反应得到的金属阳离子在阴极区可沉淀完全,从其对水的电离平衡影响角度解释其原因______________________。
(4)若溶液中初始含有0.1mol Cr2O72-,则生成的阳离子全部转化成沉淀的质量是_______g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】同温、同压下等质量的SO2气体和CO2气体,下列有关比较的叙述中,正确的是①密度比为16:11 ②密度比为11:16 ③体积比为16:11 ④体积比为11:16( )
A.①③
B.①④
C.②③
D.②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据元素周期表和元素周期律,判断下列叙述不正确的是
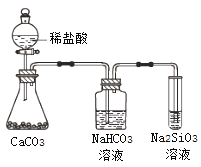
A. 气态氢化物的稳定性:H2O>NH3>SiH4
B. 氢元素与其他元素可形成共价化合物或离子化合物
C. 上图所示实验可证明元素的非金属性:Cl>C>Si
D. 用中文“![]() ”(ào)命名的第118号元素在周期表中位于第七周期0族
”(ào)命名的第118号元素在周期表中位于第七周期0族
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F是前四周期原子序数依次增大的六种元素。A元素原子的核外电子数等于其电子层数,B元素基态原子有三个能级且各能级电子数相同,A与D可形成两种常见液态化合物G、H,其原子数之比分别为1:1和2:1,E元素原子的K、L层电子数之和等于其M、N层电子数之和,F被称为继铁、铝之后的第三金属,具有良好的生物亲和性,还可用于制造飞机、火箭、人造卫星、宇宙飞船等领域,F4+和氩原子的核外电子排布相同。请回答下列各题(涉及元素请用相应化学符号表示):
(1)B、C、D中电负性最大的元素其基态原子有________种不同能量的电子。
(2)G分子中D原子的杂化方式为_____________,F2+的基态价电子排布式为____________。
(3)BA3- 离子的空间构型为________,与其互为等电子体的一种阳离子的电子式为____________。
(4)某化合物晶胞结构如右图所示,E2+的最近且等距的D2-有_________个。KIO3晶体是一种性能良好的非线性光学材料,具有与右图相似的立体结构,边长为a=0.446nm,晶胞中K、I、O分别处于顶角、体心、面心位置,K与O间的最短距离为______nm。

(5)用高能射线照射液态H时,一个H分子能释放出一个电子,同时产生一种阳离子。释放出来的电子可以被若干H分子形成的“网”捕获,你认为H分子间能形成“网”的原因________________。且由H分子释放出电子时产生的该种阳离子具有较强的氧化性,试写出该阳离子与S02的水溶液反应离子方程式______________________________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、P、Q为五种短周期元素,其原子半径和最外层电子数之间的关系如下图所示。下列说法正确的是

A. Q的氧化物一定含有离子键和共价键 B. 最高价含氧酸的酸性:Z<Y
C. P的最低价氢化物常温常压下为液体 D. Y形成的化合物种类最多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,将H2和N2置于一容积为2 L的密闭容器中发生反应。反应过程中H2、N2和NH3的物质的量变化如下图:
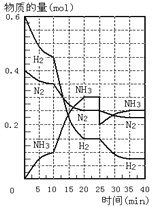
(1)计算反应开始10分钟内,NH3的平均反应速率___________
(2)反应处于平衡状态的时间是:__________________________
(3)图中10~20分钟曲线发生变化的可能原因是_______________。
(4)第25分钟,平衡改变的条件是____________________,此时正反应速率_____(填增大、减小或不变),重新达平衡后,NH3的体积分数比原平衡______(填大、小或不变)。
(5)判断该反应达到平衡状态的标志是_________________________(填字母);
a.N2和NH3浓度相等 b.NH3百分含量保持不变
c.容器中气体的压强不变 d.NH3的生成速率与H2的消耗速率相等
e.容器中混合气体的密度保持不变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com