
【题目】下列有关“物质的量”的叙述正确的是( )
A.表示物质的质量
B.表示物质的分子数目
C.物质的量的单位是摩尔
D.既表示物质质量又表示分子数目
科目:高中化学 来源: 题型:
【题目】某小组同学设计了如图所示的实验装置来进行实验探究:
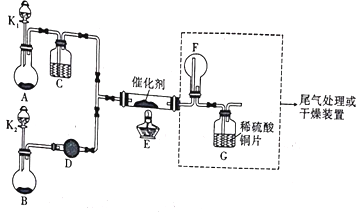
I.氨的催化氧化(4NH3+5O2 ![]() 4NO+6H2O):
4NO+6H2O):
(1)A中加入的是一种黑色的固体,B装置是制备___________的装置,D中装的试剂为___________。
(2)甲、乙同学分别按图示装置进行实验,一段时间后,装置G中的溶液都变成蓝色,甲观察到装置F中有红棕色气体,乙观察到装置F中有白烟生成。G中溶液变蓝的原因是(用离子方程式表示)______________________,白烟的成分为___________。甲、乙两同学分析了F装置现象不同的原因,乙同学通过改变实验操作:______________________,也在F中看到了红棕色气体生成。
Ⅱ.测定SO2转化为SO3的转化率:
已知:SO3的熔点是16.8℃,沸点是44.8℃。
(3)根据实验需要,应将F、G处替换成图中的装置(填序号)F.___________G._________。
(4)在A中加入 a mol Na2SO3粉末与足量浓硫酸反应,当反应结束时,让B装置继续再反应一段时间,最后测得G处装置增重bg,则此时SO2的转化率为___________(用含a、b的代数式表示)。
(5)丙同学观察整套装置后,推断该实验结果必定偏高,他更换了一个三孔橡皮塞,改动装置后重新实验,获得了更符合实际的转化率。请推断他对装置的改动是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在硫酸工业中,通过下列反应使SO2氧化成SO3:2SO2(g)+O2(g) ![]() 2SO3(g)ΔH=-198kJ·mol-1。下表为不同温度和压强下SO2的转化率(%)
2SO3(g)ΔH=-198kJ·mol-1。下表为不同温度和压强下SO2的转化率(%)
| 1×105 | 5×105 | 1×106 | 5×106 | 1×107 |
450 | 97.5 | 98.9 | 99.2 | 99.6 | 99.7 |
550 | 85.6 | 92.9 | 94.9 | 97.7 | 98.3 |
(1)实际生产中,选定400~500℃作为操作温度,其原因是_______________________。
(2)实际生产中,采用的压强为常压,其原因是__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化工小组研究银铜复合废料(表面变黑,生成Ag2S)回收银单质及制备硫酸铜晶体,工艺如下 :(废料中的其他金属含量较低,对实验影响可忽略)

已知:① AgCl可溶于氨水,生成[Ag(NH3)2]+;
② Ksp(Ag2SO4)=1.2×10-5,Ksp(AgCl)=1.8×10-10;
③渣料中含有少量银和硫酸银(微溶)。
(1)操作I中为了加快空气熔炼速率,可以采取____________措施(写出其中一种即可)。
(2)操作IV经过_______________、_________________、过滤、洗涤和干燥,可以得到硫酸铜晶体。
(3)洗涤滤渣II,与粗银合并,目的是________________________________。
(4)操作III中,NaClO溶液与Ag反应的产物为AgCl、NaOH、NaCl和O2,该反应的化学方程式为_________________________________(其中AgCl和NaCl的物质的量之比为2:1)。氧化的同时发生沉淀转化,离子方程式为______________________________,其平衡常数K=_____________________。 HNO3也能氧化Ag,从反应产物的角度分析,以HNO3代替NaClO的缺点是_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质中均为化合物的一组是
A.金刚石、干冰、SO2
B.KCl、盐酸、NaOH
C.CuSO4·5H2O、冰、AgCl
D.液氨、CaCO3、铝合金
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,某同学设计了一个燃料电池并探究氯碱工业原理和粗铜的精炼原理,其中乙装置中X为阳离子交换膜.下列有关说法正确的是( )
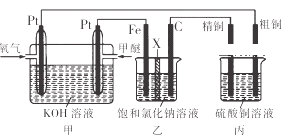
A. 反应一段时间后,乙装置中生成的氢氧化钠在铁极区
B. 乙装置中铁电极为阴极,电极反应式为Fe﹣2e ﹣=Fe2+
C. 通入氧气的一极为正极,发生的电极反应为O2﹣4e ﹣+2H2O═4OH﹣
D. 反应一段时间后,丙装置中硫酸铜溶液浓度保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知氯化氢极易溶于水,标准状况下,1体积的水可以溶解500体积的氯化氢(HCl)气体,氯化氢的水溶液即为盐酸。
实验室现有质量分数为36.5%、密度为1.19gcm﹣3的浓盐酸,若用该浓盐酸配制0.4molL﹣1的稀盐酸220mL,试回答下列问题:
(1)配制该稀盐酸时,应选用的容量瓶的容积为(______).
A. 100mL B. 220mL C. 250mL D. 500mL
(2)计算需要____mL的浓盐酸,
(3)在量取浓盐酸后,进行了下列操作:
①待稀释盐酸的温度与室温一致后,沿玻璃棒注入容量瓶中.
②往容量瓶中加蒸馏水至液面离容量瓶刻度线1~2cm时,改用胶头滴管加蒸馏水,使溶液的液面与瓶颈的刻度标线相切.
③在盛蒸馏水的烧杯中注入盐酸,并用玻璃棒搅动,使其混合均匀.
④用蒸馏水洗涤烧杯和玻璃棒2至3次,并将洗涤液全部注入容量瓶.
上述操作中,正确的顺序是(填序号)_____________。
(4)在下述配制过程中,配制的稀盐酸浓度将会偏高的是_________________;使浓度会偏低的是 _________________________。(填序号)
①未转移溶液前容量瓶中有少量的蒸馏水
②量取浓盐酸时俯视刻度线
③量取浓盐酸后用蒸馏水洗涤量筒
④若未用蒸馏水洗涤烧杯内壁或未将洗涤液注入容量瓶
⑤定容时俯视刻度线
(5)在标准状况下,用一支收集满HCl气体的试管倒立在水槽中,水倒吸当充满试管时用塞子堵住试管口竖立(假设溶液不泄漏),则该溶液的溶质的物质的量浓度为_________________(保留两位小数)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com