
【题目】已知下列数据是某些气体的相对分子质量,能用向下排空气法收集的是( )
A. 16 B. 28 C. 44 D. 64
 优百分课时互动系列答案
优百分课时互动系列答案 开心蛙状元作业系列答案
开心蛙状元作业系列答案 课时掌控随堂练习系列答案
课时掌控随堂练习系列答案科目:高中化学 来源: 题型:
【题目】关于 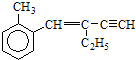 下列结论正确的是( )
下列结论正确的是( )
A.该有机物分子式为C13H16
B.该有机物分子最多有4个碳原子共直线
C.该有机物属于苯的同系物
D.该有机物分子最多有13个碳原子共平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】温州某学生用0.1000mol/L NaOH溶液滴定未知浓度的盐酸溶液,其操作可分解为如下几步: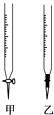
A.检查滴定管是否漏水
B.用蒸馏水洗干净滴定管
C.取下碱式滴定管用标准的NaOH溶液润洗后,将标准液注入碱式滴定管“0”刻度以上2~3cm处,再把碱式滴定管固定好,调节液面至“0”刻度或“0”刻度以下
D.用待测定的溶液润洗酸式滴定管
E.用酸式滴定管取稀盐酸20.00mL,注入锥形瓶中,加入酚酞
F.把锥形瓶放在滴定管下面,瓶下垫一张白纸,边滴边摇动锥形瓶直至滴定终点,记下滴定管液面所在刻度
G.另取锥形瓶,再重复操作一次
完成以下填空:
(1)操作F中应该选择图中 滴定管(填标号)。
(2)滴定时边滴边摇动锥形瓶,眼睛应观察 。
A.滴定管内液面的变化 B.锥形瓶内溶液颜色的变化
滴定终点溶液颜色的变化是 .若指示剂改为甲基橙则颜色的变化是 。
(3)滴定结果如表所示:
滴定次数 | 待测液体积/mL | 标准溶液的体积/mL | ||
滴定前刻度 | 滴定后刻度 | |||
① | 20 | 1.02 | 21.03 | |
② | 20 | 2.00 | 25.00 | |
③ | 20 | 0.60 | 20.59 | |
滴定中误差较大的是第 次实验,造成这种误差的可能原因是 。
A.碱式滴定管在装液前未用标准NaOH溶液润洗2~3次
B.滴定开始前碱式滴定管尖嘴部分有气泡,在滴定终点读数时未发现气泡
C.滴定开始前碱式滴定管尖嘴部分没有气泡,在滴定终点读数时发现尖嘴部分有气泡
D.达到滴定终点时,仰视溶液凹液面最低点读数
E.滴定过程中,锥形瓶摇荡得太剧烈,以致有些液滴飞溅出来
(4)该盐酸的浓度为mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组中的两种物质作用时,反应条件(温度、反应物用量)改变,不会引起产物种类改变的是( )
A.Na和O2B.Fe和O2
C.Fe和HClD.C和O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】立足教材实验是掌握高中化学实验的基础,是理解化学科学的实验原理、实验方法和实验思路,提高学生实验能力的基本途径:
(1)实验1:取一块金属钠,在玻璃片上用滤纸吸干表面的煤油后,用小刀切去一端的外皮,观察钠的颜色,这个实验中还需用到的一种仪器是_________;
(2)实验2:向一个盛有水的小烧杯里滴入几滴酚酞试液,然后把一小块钠投入小烧杯,把反应的现象和相应结论填入空格,“浮”--钠的密度比水小;“红”--反应生成了氢氧化钠;“熔”——______________;
(3)实验3:用坩埚钳夹住一小块用砂纸仔细打磨过的铝,在酒精灯上加热至熔化,发现熔化的铝并不滴落。下列关于上述实验现象的解释正确的是_________
A.火焰温度太低不能使铝燃烧 B.铝在空气中能很快形成氧化膜
C.氧化铝的熔点比倡的熔点高 D.打磨砂纸不能除去表面的氧化膜
(4)实验4:把少量水滴入盛有Na2O2固体的试管中,立即用带火星的木条放在试管口,检验
生成的气体体,向反应后的溶液中加入酚酞试液,可以看到__________;
(5)实验5:在玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,该氧化还原反应的氧化剂是__________,该反应每消耗1mol铁,转移电子的物质的量为_________。
(6)实验6:在试管中注入少量新制备的FeSO4溶液,用胶头滴管吸取NaOH溶液,将滴管尖端插入试管里溶液底部,慢慢挤出NaOH溶液,可以看到开始时析出一种白色的絮状沉淀,并迅速变成灰绿色,最后变成红褐色,发生这种颜也变化的原因是(用化学方程式表示):______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】KClO3和浓盐酸在一定温度下反应会生成黄绿色的易爆物二氧化氯。其变化可表述为: 2KClO3 +4HCl(浓)===2KCl+2ClO2↑+Cl2↑+2H2O。
(1)请分析该反应中电子转移的情况:(单线桥法表示)________________________。
(2)氧化剂与还原剂的物质的量之比是 ___________________
(3)若产生标况下22.4 L Cl2,则转移的电子的物质的量为________mol。
(4)实验室备用的浓盐酸质量分数为36.5%,密度为1.19 g·cm-3,为使用方便,请计算出该浓盐酸中HCl的物质的量浓度 mol·L-1。
(5)ClO2对污水中Fe2+、Mn2+、S2-和CN- 等有明显的去除效果。某工厂污水中含CN- a mg/L,现用ClO2将CN - 氧化,只生成两种气体,其离子反应方程式为为 ,处理100 m3这种污水,至少需要ClO2 _______mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家为实现“低碳”构想,把空气中的CO2转化为可再生能源甲醇(CH3OH).该反应的热化学方程式为: CO2(g)+3H2(g)CH3OH(g)+H2O(g)△H
(1)若在一个定温定容的容器中发生上述反应,反应达到平衡的标志是 . (填编号)
A.H2O(g)和CH3OH(g)的浓度相等
B.H2的百分含量保持不变
C.容器内压强保持不变
D.v (H2)=3v (H2O)
E.容器中混合气体的密度保持不
(2)若将CO2和H2的混合气体分成五等份,将它们分别充入温度不同、容积相同的恒容容器中发生上述反应.反应相同时间后,测得甲醇的体积分数Φ(CH3OH)与反应温度T的关系如图1,则上述CO2转化为甲醇的反应的平衡常数表达式为 , 升高温度该平衡常数(填“增大”、“减小”、“不变”) 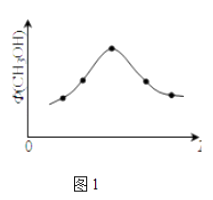
(3)300℃时,将CO2与H2按1:3的体积比充入某密闭容器中,CO2的平衡转化率(α)与体系总压强(P)的关系如图2所示.回答下列问题: 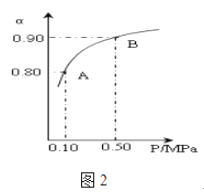
①若其他条件不变,将A点的体积压缩至原来的一半,一段时间后反应再次达到平衡,与原平衡相比较下列说法正确的是 . (填编号)
A.CO2的浓度减小
B.正反应速率增大,逆反应速率减小
C.CO2和H2的体积比仍然是1:3
D.H2的体积分数减小
②A点平衡混合气体的平均摩尔质量为(保留一位小数).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】结合所学内容,完成下列问题:
(1)过氧化钠固体的颜色是______________。
(2)写出磁性氧化铁的化学式_____________,小苏打的化学式____________。
(3)写出实验室加热NH4Cl和Ca(OH)2的混合物制取NH3的化学方程式:_______。
(4)若要提取饱和碘水中的碘,所用的萃取剂可以是___________(填序号)。
① 四氯化碳 ② 酒精 ③ 淀粉溶液
(5)红热的木炭与浓硝酸反应的化学方程式为:C+4HNO3(浓)=CO2↑+4NO2↑+2H2O,该反应中氧化剂和还原剂的物质的量之比为_________;如果产生标准状况下22.4 L CO2,则转移的电子的物质的量为________mol。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com