
将90%H2SO4溶液和10%H2SO4溶液等体积混合,所得溶液的百分比浓度 为( )
为( )
A.小于50% B.大于50% C.等于50% D.不能确定
科目:高中化学 来源: 题型:
某同学按图示装置进行实验:A极是铜锌合金,B极为纯铜,溶液为足量的硫酸铜溶液。通电一段时间后,若A极恰好全部溶解,此时B极质量增加5.76g,溶液质量增0.03g,则合金中Cu、Zn原子个数比为

A.4:1 B.3:1 C.2:1 D.任意比
查看答案和解析>>
科目:高中化学 来源: 题型:
25℃、101kPa 下:①2Na(s)+1/2O2(g)=Na2O(s) △H1=-414KJ/mol
②2Na(s)+O2(g)=Na2O2(s) △H2=-511KJ/mol
下列说法正确的是
A.①和②产物的阴阳离子个数比不相等
B.①和②生成等物质的量的产物,转移电子数不同
C.常温下Na与足量O2反应生成Na2O,随温度升高生成Na2O的速率逐渐加快
D.25℃、101kPa 下,Na2O2(s)+2Na(s)= 2Na2O(s) △H=-317kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
锅炉水垢是一种安全隐患,除去水垢中的CaSO4,可先用Na2CO3溶液处理,使之转化为易溶于酸的CaCO3,而后用酸除去。下列说法不正确的是
A.CaCO3的溶解度小于CaSO4
B.沉淀转化的实质是沉淀溶解平衡的移动
C.沉淀转化的难易与溶解度差别的大小无关
D.CaSO4到CaCO3的沉淀转化中并存着两个沉淀溶解平衡
查看答案和解析>>
科目:高中化学 来源: 题型:
氨气是中学化学中常见的气体,其用途广泛。
(1)实验室制取氨气的化学方程式是 。
|

|

|
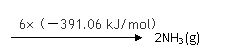
 |
① 该反应的热化学方程式是 。
② 随着温度的升高,该反应的化学平衡常数的变化趋势是 。
③ 一定温度下,2 L密闭容器中,5 molN2和5 molH2发生反应,达到平衡时,N2的转化率为20%,该温度下反应的平衡常数的数值是 (填字母)。
④ 简述一种检查氨气是否泄露可采用的化学方法: 。
(3)工业制硫酸的尾气中含较多的SO2,为防止污染空气,回收利用SO2,工业上常用氨水吸收法处理尾气。
① 当氨水中所含氨的物质的量为3 mol ,吸收标准状况下44.8 L SO2时,溶液中的溶质为 。
② (NH4)2SO3显碱性,用化学平衡原理解释 。
③ NH4HSO3显酸性。用氨水吸收SO2,当吸收液显中性时,溶液中离子浓度关系正确的是 (填字母)。
a.c(NH4+) = 2c(SO32-) + c(HSO3-)
b.c(NH4+)> > c(SO32-)> c(H+)= c(OH-)
c.c(NH4+)+ c(H+)= c(SO32-)+c(HSO3-)+c(OH-)
(4)氨气是一种富氢燃料,可以直接用于燃料电池,下图是供氨水式燃料电池工作原理:
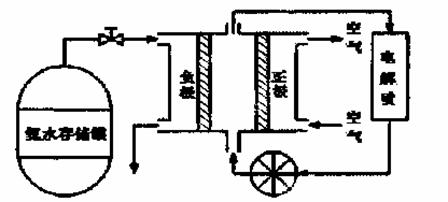
① 氨气燃料电池的电解质溶液最好选择 (填“酸性”、“碱性”或“中性”)溶液。
② 空气在进入电池装置前需要通过过滤器除去的气体是 。
③ 氨气燃料电池的反应是氨气与氧气生成一种常见的无毒气体和水,该电池的电极总反应是 ,正极的电极反应方是
查看答案和解析>>
科目:高中化学 来源: 题型:
在同温同压下,相同体积的烧 瓶分别充满氨气和氯化氢气体,做喷泉实验后,水都充满烧瓶,烧瓶中溶液的物质的量浓度之比是( )
瓶分别充满氨气和氯化氢气体,做喷泉实验后,水都充满烧瓶,烧瓶中溶液的物质的量浓度之比是( )
A.1∶0.45 B.1∶1 C.1∶0.29 D.4.5∶2.9
查看答案和解析>>
科目:高中化学 来源: 题型:
从降低成本和减少环境污染的角度考虑,制取硝酸铜最好的方法是( )
A.铜和浓硝酸反应 B.铜和稀硝酸反应
C.氧化铜和硝酸反应 D.氯化铜和硝酸银反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com