
氨气是中学化学中常见的气体,其用途广泛。
(1)实验室制取氨气的化学方程式是 。
|

|

|
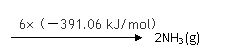
 |
① 该反应的热化学方程式是 。
② 随着温度的升高,该反应的化学平衡常数的变化趋势是 。
③ 一定温度下,2 L密闭容器中,5 molN2和5 molH2发生反应,达到平衡时,N2的转化率为20%,该温度下反应的平衡常数的数值是 (填字母)。
④ 简述一种检查氨气是否泄露可采用的化学方法: 。
(3)工业制硫酸的尾气中含较多的SO2,为防止污染空气,回收利用SO2,工业上常用氨水吸收法处理尾气。
① 当氨水中所含氨的物质的量为3 mol ,吸收标准状况下44.8 L SO2时,溶液中的溶质为 。
② (NH4)2SO3显碱性,用化学平衡原理解释 。
③ NH4HSO3显酸性。用氨水吸收SO2,当吸收液显中性时,溶液中离子浓度关系正确的是 (填字母)。
a.c(NH4+) = 2c(SO32-) + c(HSO3-)
b.c(NH4+)> > c(SO32-)> c(H+)= c(OH-)
c.c(NH4+)+ c(H+)= c(SO32-)+c(HSO3-)+c(OH-)
(4)氨气是一种富氢燃料,可以直接用于燃料电池,下图是供氨水式燃料电池工作原理:
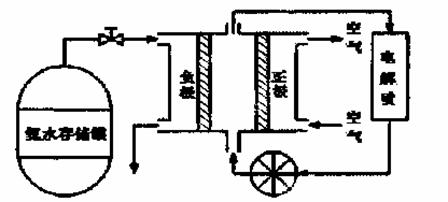
① 氨气燃料电池的电解质溶液最好选择 (填“酸性”、“碱性”或“中性”)溶液。
② 空气在进入电池装置前需要通过过滤器除去的气体是 。
③ 氨气燃料电池的反应是氨气与氧气生成一种常见的无毒气体和水,该电池的电极总反应是 ,正极的电极反应方是
 小学教材全测系列答案
小学教材全测系列答案 小学数学口算题卡脱口而出系列答案
小学数学口算题卡脱口而出系列答案 优秀生应用题卡口算天天练系列答案
优秀生应用题卡口算天天练系列答案科目:高中化学 来源: 题型:
MOH和ROH两种一元碱的溶液分别加水稀释时,
pH变化。如右图所示。下列叙述中正确的是
A.ROH是一种弱碱
B.在x点,c(M+) = c(R+)
C.在x点, MOH完全电离
D.稀释前,c(ROH) =10 c(MOH)
 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是
A.葡萄糖和麦芽糖属于还原型糖
B.用新制的银氨溶液可区分甲酸和乙醛
C.乙烯和苯都能使溴水褪色,褪色的原因相同
D.淀粉和纤维素的化学式均为(C6H10O5)n,两者互为同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
接触法制硫酸工艺中,其主反应在450℃并有催化剂存在下进行:
2SO2(g) + O2(g)  2SO3(g)
2SO3(g)  H=-197 kJ/mol
H=-197 kJ/mol
下列说法正确的是
A.使用催化剂可以提高SO2的转化率
B.增大O2的浓度可以提高反应速率和SO2的转化率
C.反应450℃时的平衡常数小于500℃时的平衡常数
D.2 mol SO2(g) 和1 mol O2(g)所含的总能量小于2 mol SO3(g) 所含的总能量
查看答案和解析>>
科目:高中化学 来源: 题型:
将20mLNO2和NH3的混合气体,在一定条件下充分反应, 化学方程式是:6NO2+8NH3
化学方程式是:6NO2+8NH3 7N2+12H2O。已知参加反应的NO2比NH3少2mL(气体体积均在相同状况下测定),则原混合气体中NO2和NH
7N2+12H2O。已知参加反应的NO2比NH3少2mL(气体体积均在相同状况下测定),则原混合气体中NO2和NH 3的物质的量之比是( )
3的物质的量之比是( )
A.3∶2 B.2∶3 C.3∶7 D.3∶4
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组离子在无色溶液中能大量共存的是
A.H+、Cl-、SO42-、K+ B.K+、H+、Na+、HCO3-
C.Cu2+、K+、SO42-、Cl- D.Ag+、NO3-、Cl-、K+
查看答案和解析>>
科目:高中化学 来源: 题型:
苯甲酸广泛应用于制药和化工行业。某化学小组用甲苯作主要原料制备苯甲酸,反应
过程如下:

甲苯、苯甲酸钾、苯甲酸的部分物理性质见下表:
| 物质 | 熔点/℃ | 沸点/℃ | 密度/g·cm-3 | 在水中溶解性 |
| 甲苯 | -95 | 110.6 | 0.8669 | 难溶 |
| 苯甲酸钾 | 121.5~123.5 |
|
| 易溶 |
| 苯甲酸 | 122.4 | 248 | 1.2659 | 微溶 |
(1)将步骤①得到混合物加少量水,分离有机相和水相。有机相在 ▲ (填“上”或“下”)层;实验操作的名称是 ▲ 。
(2)步骤②用浓盐酸酸化的目的是 ▲ 。
(3)减压过滤装置所包含的仪器除减压系统外,还有 ▲ 、 ▲ (填仪器名称)。
(4)已知温度越低苯甲酸的溶解度越小,但为了得到更多的苯甲酸晶体,重结晶时并非温度越低越好,理由是 ▲ 。
(5)重结晶时需要趁热过滤,目的是 ▲ 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com