
��12�֣���ҵ��һ��ɲ������·�Ӧ���ϳɼ״���
CO(g)+2H2(g)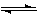 CH3OH(g) ��H����a kJ��mol��1
CH3OH(g) ��H����a kJ��mol��1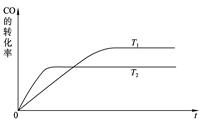
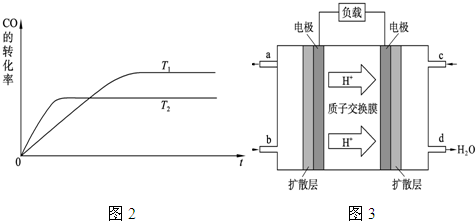
��1����ͼ�Ǹ÷�Ӧ�ڲ�ͬ�¶���CO��ת������ʱ��仯�����ߡ�
��a __0������� ������ ����������
������˵����ȷ����_ _������ţ���
a��1mol CO(g)��2mol H2(g)�����������1mol CH3OH(g)���������
b����1mol CO(g)��2mol H2(g)����һ�ܱ������г�ַ�Ӧ��ų�a KJ������
c�������¶ȣ�ƽ�����淴Ӧ�ƶ��������Ȼ�ѧ����ʽ�е�aֵ����С
d���罫һ����CO(g) ��H2(g)����ij�ܱ������г�ַ�Ӧ�����aKJ����˹�������1molCO(g)����ԭ
��2����һ�������£���ѧ�����ô��̵����з����CO2��̫���ܵ�ص��ˮ������H2�ϳɼ״������������ͼ��ʾ��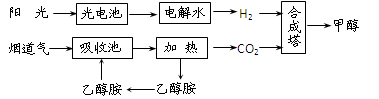
���úϳ�·�߶��ڻ��������ļ�ֵ����_ _��
��15%��20%���Ҵ�����HOCH2CH2NH2��ˮ��Һ���������ԣ������ϳ���·������CO2
���ռ��������ӷ���ʽ��ʾ�Ҵ���ˮ��Һ�������Ե�ԭ��
��
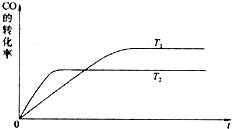
��3���״�ȼ�ϵ�صĹ���ԭ��������ͼ��ʾ���õ�ع���ʱ��c��ͨ������ʷ����ĵ缫
��ӦʽΪ��_ _��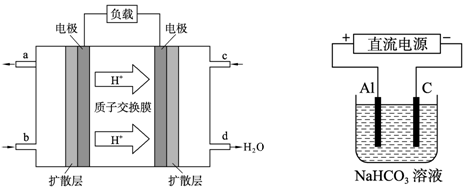
��4���������������Դ��������ͼ��ʾװ�ã���ʵ������ģ������Ʒ���桰�ۻ��������Ĺ����У�������Һ����ǣ�ԭ���ǣ�����صĵ缫��Ӧʽ�����ӷ���ʽ��ʾ����
_ ��
 ��˼ά������ҵϵ�д�
��˼ά������ҵϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
| c(CH3OH) |
| c(CO)��c2(H2) |
| c(CH3OH) |
| c(CO)��c2(H2) |
| b-a-4c |
| 2 |
| b-a-4c |
| 2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����

| c(CH3OH) |
| c(CO)?c2H(2) |
| c(CH3OH) |
| c(CO)?c2H(2) |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| [CH3OH] |
| [CO][H2]2 |
| [CH3OH] |
| [CO][H2]2 |

| b-a-4c |
| 2 |
| b-a-4c |
| 2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 �״���һ�ֿ�������Դ�����п�����Ӧ�õĹ���ǰ������ҵ��һ��ɲ������·�Ӧ���ϳɼ״���CO��g��+2H2��g��?CH3OH��g����
�״���һ�ֿ�������Դ�����п�����Ӧ�õĹ���ǰ������ҵ��һ��ɲ������·�Ӧ���ϳɼ״���CO��g��+2H2��g��?CH3OH��g����| c(CH3OH) |
| c(CO)?c2(H2) |
| c(CH3OH) |
| c(CO)?c2(H2) |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com