
【题目】“84”消毒液在日常生活中使用广泛,该消毒液无色,有漂白作用.它的有效成分是下列物质中的一种,这种物质是:
A.Na2O2B.NaOHC.KMnO4D.NaClO
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】分别取40mL的0.50mol/L盐酸与40mL0.55mol/L氢氧化钠溶液进行中和热的测定.下列说法错误的是( )

A.稍过量的氢氧化钠是确保盐酸完全反应
B.仪器A的名称是环形玻璃搅拌棒
C.在实验过程中,把温度计上的酸用水冲洗干净后再测量NaOH溶液的温度
D.用Ba(OH)2和硫酸代替盐酸和氢氧化钠溶液,结果也是正确的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在0.1mol/LCH3COOH溶液中存在如下电离平衡:CH3COOH![]() CH3COO-+H+对于该平衡,下列叙述正确的是( )
CH3COO-+H+对于该平衡,下列叙述正确的是( )
A. 加入水时,平衡向逆反应方向移动
B. 加入少量NaOH固体,平衡向正反应方向移动
C. 加入少量0.1mol·L-1 HCl溶液,溶液中c(H+)减小
D. 加入少量CH3COONa固体,平衡向正反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
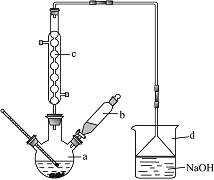
【题目】溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如下:
苯 | 溴 | 溴苯 | |
密度/g·cm-3 | 0.88 | 3.10 | 1.50 |
沸点/℃ | 80 | 59 | 156 |
水中溶解度 | 微溶 | 微溶 | 微溶 |
按下列合成步骤回答问题:
(1)在a中加入15mL无水苯和少量铁屑。在b中小心加入4.0mL液态溴。向a中滴入几滴溴,有白色烟雾产生,是因为生成了______气体。该反应为_______(填“吸热”或“放热”)反应,冷却水流向是_____________(填“上进下出”或“下进上出”),继续滴加至液溴滴完。其中仪器c的名称是________,其作用是:__________________________________。装置d的作用是:_____________________________________________________;烧瓶中发生的有机反应的方程式为:_______________________________________________。
(2)液溴滴完后,经过下列步骤分离提纯:
①向a中加入10mL水,然后过滤除去未反应的铁屑;
②滤液依次用10mL水、8mL 10%的NaOH溶液、10mL水洗涤。洗涤、分离有机和无机试剂,需要用到的仪器是:_____________。第一次水洗除去大部分的HBr;用NaOH溶液洗涤的作用是______________;第二次水洗的目的是:____________;每一次洗涤,有机层从_________(填“下口放出”或“上口倒出”),棕黄色的溴苯经过提纯后恢复为无色。
③向分出的粗溴苯中加入少量的无水氯化钙,静置、过滤。加入氯化钙的目的是_____________。
(3)经以上分离操作后,粗溴苯中还含有的主要杂质苯,要进一步提纯,下列操作中必须的是____(填入正确选项前的字母)。
A.蒸馏 B.渗析 C.分液 D.萃取
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨工业在国民生产中有重要意义。回答下列问题:
(1)在恒温恒压条件下,在装置中发生合成氨的反应N2(g)+3H2(g)![]() 2NH3(g) ,下列说法正确的是(______)(填字母)
2NH3(g) ,下列说法正确的是(______)(填字母)
A.气体体积不再变化,则已经平衡
B.气体密度不再变化,可能尚未达到平衡
C.平衡后,向装置中通入氩气,压强不变,平衡不移动
D.平衡后,压缩体积,则生成更多的氨气
E.催化剂可以提高生产氨气的产率
(2)N2(g)+3H2(g)![]() 2NH3(g) ΔH = —92.0 kJ·mol-1,恒容时,体系中各物质浓度随时间变化曲线如图1所示。
2NH3(g) ΔH = —92.0 kJ·mol-1,恒容时,体系中各物质浓度随时间变化曲线如图1所示。
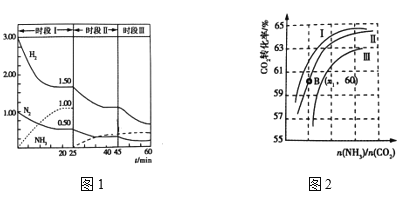
①25min时采取的措施是 _______________________________ 。
②三个时间段分别是改变一个条件引起的平衡移动,平衡时平衡常数KⅠ、KⅡ、KⅢ的大小关系 __________________。
③在实际工业生产中和①中措施的目的相同的其他措施还有 _____________________(写两条)
(3)①合成氨工艺生产中间环节产生的CO会导致催化剂中毒,常用铜液[醋酸二氨合铜(Ⅰ)、氨水]吸收,Cu(NH3)2Ac + CO + NH3 ![]() [Cu(NH3)3CO]Ac ΔH<0。简述吸收CO及铜液再生的操作步骤(注明吸收和再生的条件)__________________________________________________________________________
[Cu(NH3)3CO]Ac ΔH<0。简述吸收CO及铜液再生的操作步骤(注明吸收和再生的条件)__________________________________________________________________________
②如果要提高上述反应的反应速率,且提高氨气的转化率,可采取的措施有(______)
a. 加压 b.加催化剂 c.升温 d.及时移走产物
(4)①用氨气制取尿素[CO(NH2)2]的反应为:2NH3(g)+CO2(g)![]() CO(NH2)2(l)+H2O(g) ΔH<0。已知该反应的v (正)=k(正)c2(NH3)c(CO2),v (逆)=k(逆)c(H2O),k(正)和k(逆)为速率常数,则平衡常数K与k(正)、k(逆)的关系式是__________________
CO(NH2)2(l)+H2O(g) ΔH<0。已知该反应的v (正)=k(正)c2(NH3)c(CO2),v (逆)=k(逆)c(H2O),k(正)和k(逆)为速率常数,则平衡常数K与k(正)、k(逆)的关系式是__________________
②实际生产中,原料气带有水蒸气,图2表示CO2转化率与氨碳比![]() 、水碳比
、水碳比![]() 的变化关系。
的变化关系。
a. 曲线Ⅰ、Ⅱ、Ⅲ对应的水碳比![]() 最大的是_______________。
最大的是_______________。
b.测得B点氨的转化率为40%,则X1= _________________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学探究金属Na与CO2的反应,实验如下:
实验I | 实验II | |
操作 | 将点燃的金属钠伸到盛有CO2的集气瓶中 | 将实验I的集气瓶用水冲洗,过滤。取黑色滤渣灼烧;取滤液分别滴加酚酞和氯化钡溶液 |
现象 | ①火焰呈黄色 ②底部有黑色固体,瓶壁上附有白色固体 | ①黑色滤渣可燃 ②滤液能使酚酞溶液变红,滴加氯化钡溶液有白色沉淀生成 |
下列说法不正确的是
A. 生成的黑色固体中含有CB. 白色固体是Na2O
C. 实验说明CO2具有氧化性D. 金属Na着火不能用CO2灭火
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙烯是重要有机化工原料。结合以下路线回答:
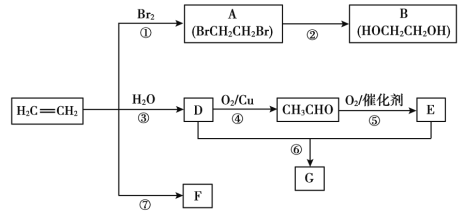
已知:2CH3CHO + O2催化剂,加热2CH3COOH
(1)反应①的化学方程式是_______。
(2)B的官能团是_______。
(3)F是一种高分子,可用于制作食品袋,其结构简式为_______。
(4)G是一种油状、有香味的物质,有以下两种制法。
制法一:实验室用D和E反应制取G,装置如图所示。

i.反应⑥的化学方程式是______,反应类型是_____。
ii.分离出试管乙中油状液体用到的主要仪器是_______。
制法二:工业上用CH2=CH2和E直接反应获得G。
iii.反应类型是___。
iv.与制法一相比,制法二的优点是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸亚铁是一种重要的化工原料,可以制备一系列物质(如图所示),下列说法错误的是

A. 碱式硫酸铁水解能产生Fe(OH)3胶体,可用作净水剂
B. 为防止NH4HCO3分解,生产FeCO3需在较低温度下进行
C. 可用KSCN溶液检验(NH4)2Fe(SO4)2是否被氧化
D. 常温下,(NH4)2Fe(SO4)2比FeSO4易溶于水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列无色溶液中,能大量共存的离子组是( )
A.Cu2+、H+、I-、SO42-B.Na+、Ba2+、NO3-、OH-
C.K+、Mg2+、CO32-、Cl-D.K+、H+、Cl-、MnO4-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com