
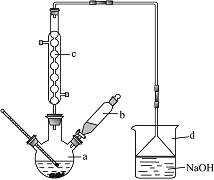
【题目】溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如下:
苯 | 溴 | 溴苯 | |
密度/g·cm-3 | 0.88 | 3.10 | 1.50 |
沸点/℃ | 80 | 59 | 156 |
水中溶解度 | 微溶 | 微溶 | 微溶 |
按下列合成步骤回答问题:
(1)在a中加入15mL无水苯和少量铁屑。在b中小心加入4.0mL液态溴。向a中滴入几滴溴,有白色烟雾产生,是因为生成了______气体。该反应为_______(填“吸热”或“放热”)反应,冷却水流向是_____________(填“上进下出”或“下进上出”),继续滴加至液溴滴完。其中仪器c的名称是________,其作用是:__________________________________。装置d的作用是:_____________________________________________________;烧瓶中发生的有机反应的方程式为:_______________________________________________。
(2)液溴滴完后,经过下列步骤分离提纯:
①向a中加入10mL水,然后过滤除去未反应的铁屑;
②滤液依次用10mL水、8mL 10%的NaOH溶液、10mL水洗涤。洗涤、分离有机和无机试剂,需要用到的仪器是:_____________。第一次水洗除去大部分的HBr;用NaOH溶液洗涤的作用是______________;第二次水洗的目的是:____________;每一次洗涤,有机层从_________(填“下口放出”或“上口倒出”),棕黄色的溴苯经过提纯后恢复为无色。
③向分出的粗溴苯中加入少量的无水氯化钙,静置、过滤。加入氯化钙的目的是_____________。
(3)经以上分离操作后,粗溴苯中还含有的主要杂质苯,要进一步提纯,下列操作中必须的是____(填入正确选项前的字母)。
A.蒸馏 B.渗析 C.分液 D.萃取
【答案】HBr 放热 下进上出 球形冷凝管 冷凝回流溴和苯,减少原料挥发损失 吸收HBr和Br2,防止污染环境,同时可以防止倒吸 ![]() +Br2
+Br2![]()
![]() +HBr 分液漏斗 除去Br2和少量的HBr 除去NaOH 下口放出 吸收水分 A
+HBr 分液漏斗 除去Br2和少量的HBr 除去NaOH 下口放出 吸收水分 A
【解析】
(1)苯与液溴在铁或溴化铁作催化剂下发生取代反应,即反应方程式为![]() +Br2
+Br2![]()
![]() +HBr,HBr气体遇到水蒸气会产生白雾,即白雾是HBr;苯与液溴发生反应是放热反应;为了增加冷却效果,即冷却水流向是下进上出;仪器c为球形冷凝管,冷凝管的作用是冷凝挥发出来的苯和液溴,并使它们流回到三颈烧瓶中,提高反应的转化率,减少原料挥发损失;苯与液溴反应生成HBr,苯的卤代反应是放热反应,液溴易挥发,因此尾气中有HBr及挥发出的Br2,用氢氧化钠溶液吸收,防止污染大气,所以装置d的作用是吸收HBr和Br2,同时用倒扣的漏斗防止倒吸;发生的反应方程式为
+HBr,HBr气体遇到水蒸气会产生白雾,即白雾是HBr;苯与液溴发生反应是放热反应;为了增加冷却效果,即冷却水流向是下进上出;仪器c为球形冷凝管,冷凝管的作用是冷凝挥发出来的苯和液溴,并使它们流回到三颈烧瓶中,提高反应的转化率,减少原料挥发损失;苯与液溴反应生成HBr,苯的卤代反应是放热反应,液溴易挥发,因此尾气中有HBr及挥发出的Br2,用氢氧化钠溶液吸收,防止污染大气,所以装置d的作用是吸收HBr和Br2,同时用倒扣的漏斗防止倒吸;发生的反应方程式为![]() +Br2
+Br2![]()
![]() +HBr;
+HBr;
(2)②分离有机和无机试剂,采用的方法是分液,需要用到的仪器是分液漏斗;纯净的溴苯为无色,实验中制备的溴苯,因溶解Br2而显褐色,因此洗涤时加入NaOH的目的是把未反应的Br2转化成NaBr和NaBrO,以及除去少量的HBr;第二次水洗的目的是除去过量的NaOH;溴苯的密度大于水,因此每一次洗涤,有机层从下口放出;
③无水氯化钙为干燥剂,加入氯化钙的目的是吸收水分,干燥溴苯;
(3)苯是良好的有机溶剂,溴苯和苯互溶,进一步提纯,需要采用蒸馏的方法进行,故A正确。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】从海带中提取碘单质,成熟的工艺流程如下,下列关于海水制碘的说法,正确的是( )
干海带![]() 海带灰
海带灰![]() 悬浊液
悬浊液![]() 滤液
滤液![]() 碘水
碘水![]() I2的CCl4溶液
I2的CCl4溶液![]() I2
I2
A. 实验室在蒸发皿中灼烧干海带,并且用玻璃棒搅拌
B. 含I-的滤液中加入稀硫酸和过氧化氢后,碘元素发生还原反应
C. 在碘水中加入几滴淀粉溶液,溶液变蓝色
D. 碘水加入CCl4得到I2的CCl4溶液,该操作为“萃取”
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在某澄清透明的溶液中,下列各组离子中能大量共存的是
A. I-、NO3-、Fe2+、Na+ B. Ag+、NO3-、Cl-、K+
C. K+、Ba2+、OH-、SO42- D. Cu2+、NH4+、Br-、OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某物质灼烧时,焰色反应为黄色,下列判断中正确的是
A. 该物质一定是钠的化合物 B. 该物质一定含钠元素
C. 可以确定该物质中不含钾元素 D. 该物质一定是金属钠
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某探究小组用HNO3与大理石反应过程中质量减小的方法,研究影响反应速率的因素。所用HNO3浓度为1.00 mol·L-1、2.00 mol·L-1,大理石有细颗粒与粗颗粒两种规格,实验温度为298 K、308 K,每次实验HNO3的用量为25.0 mL、大理石用量为10.00 g。
(1)请完成以下实验设计表,并在实验目的一栏中填出对应的实验编号:
实验编号 | T/K | 大理石规格 | HNO3浓度/mol·L-1 | 实验目的 |
① | 298 | 粗颗粒 | 2.00 | (Ⅰ)实验①和②探究HNO3浓度对该反应速率的影响; (Ⅱ)实验①和③探究温度对该反应速率的影响; (Ⅲ)实验①和④探究大理石规格(粗、细)对该反应速率的影响; |
② | _____ | _____ | _____ | |
③ | _____ | _____ | _____ | |
④ | _____ | _____ | _____ |
(2)实验装置如图1所示,如何检验该装置的气密性________________________________

(3)实验①中CO2质量随时间变化的关系见下图2:依据反应方程式CaCO3+2HNO3=Ca(NO3)2+CO2↑+H2O,计算实验①在70-90 s范围内HNO3的平均反应速率________________________
(4)请在答题卡的框图中,画出实验②、③和④中CO2质量随时间变化关系的预期结果示意图。_______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“84”消毒液在日常生活中使用广泛,该消毒液无色,有漂白作用.它的有效成分是下列物质中的一种,这种物质是:
A.Na2O2B.NaOHC.KMnO4D.NaClO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,水的电离可达到平衡:H2O ![]() H++OH- △H>0,下列叙述正确的是( )
H++OH- △H>0,下列叙述正确的是( )
A. 向水中加入稀氨水,平衡逆向移动,c(OH-)降低
B. 将水加热,Kw增大,pH不变
C. 向水中加入少量稀硫酸,c(H+)增大,Kw不变
D. 向水中加入少量冰醋酸,平衡逆向移动,c(H+)降低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】葡萄酒中的酒精是葡萄果实中的糖发酵后的产物(C6H12O6![]() 2CH3CH2OH+2CO2↑)。
2CH3CH2OH+2CO2↑)。
Ⅰ、已知:实验室制乙烯原理为CH3CH2OH![]() CH2=CH2↑+H2O,产生的气体能使Br2的四氯化碳溶液褪色,甲、乙同学用下列实验验证。(气密性已检验,部分夹持装置略)。
CH2=CH2↑+H2O,产生的气体能使Br2的四氯化碳溶液褪色,甲、乙同学用下列实验验证。(气密性已检验,部分夹持装置略)。

实验操作和现象:
操 作 | 现 象 |
点燃酒精灯,加热至170℃ | Ⅰ:A中烧瓶内液体渐渐变黑 |
…… | |
实验完毕,清洗烧瓶 | Ⅲ:A中烧瓶内附着少量黑色颗粒状物,有刺激性气味逸出 |
(1)溶液“渐渐变黑”,说明浓硫酸具有 性。
(2)分析,甲认为是C2H4,乙认为不能排除SO2的作用。
①根据甲的观点,使B中溶液褪色反应的化学方程式是 ;
②乙根据现象认为实验中产生的SO2和 ,使B中有色物质反应褪色。
③为证实各自观点,甲、乙重新实验,设计与现象如下:
甲:在A、B间增加一个装有某种试剂的洗气瓶;现象:Br2的CCl4溶液褪色。
乙:用下列装置按一定顺序与A连接:(尾气处理装置略)

现象:C中溶液由红棕色变为浅红棕色时,E中溶液褪色。
请回答下列问题:
a.甲设计实验中A、B间洗气瓶中盛放的试剂是 ;乙设计的实验D中盛放的试剂是 ,装置连接顺序为 。
b.能说明确实是SO2使E中溶液褪色的实验是 。
c.乙为进一步验证其观点,取少量C中溶液,加入几滴BaCl2溶液,振荡,产生大量白色沉淀,浅红棕色消失,发生反应的离子方程式是 。由此可得出的干燥的SO2不能使Br2的四氯化碳溶液褪色
Ⅱ、葡萄酒中常用Na2S2O5做抗氧化剂。
(3)0.5molNa2S2O5溶于水配成1L溶液,该溶液的pH=4.5。溶液中部分微粒浓度随溶液酸碱性变化如图所示。写出Na2S2O5溶于水时发生的化学方程式 。

(4)已知:Ksp[BaSO4]=1×10-10,Ksp[BaSO3]=5×10-7。把部分被空气氧化的该溶液的pH调为10,向溶液中滴加BaCl2溶液使SO42-沉淀完全[c(SO42-)≤1×10-5mol·L-1],此时溶液中c(SO32-)≤ mol·L-1。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com