
【题目】某物质灼烧时,焰色反应为黄色,下列判断中正确的是
A. 该物质一定是钠的化合物 B. 该物质一定含钠元素
C. 可以确定该物质中不含钾元素 D. 该物质一定是金属钠
科目:高中化学 来源: 题型:
【题目】白磷与氧可发生如下反应:P4+5O2=P4O10。已知断裂下列化学键需要吸收的能量分别为:P—P akJ·mol—1、P—O bkJ·mol—1、P="O" ckJ·mol—1、O="O " dkJ·mol—1。

根据图示的分子结构和有关数据估算该反应的△H,其中正确的是( )
A. (6a+5d-4c-12b)kJ·mol—1B(4c+12b-6a-5d)kJ·mol—1 B. (4c+12b-4a-5d)kJ·mol—1
C. (4a+5d-4c-12b)kJ·mol—1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“酒是陈的香”,是因为酒在储存过程中生成了有香味的乙酸乙酯。在实验室我们可以用如图所示的装置来制取乙酸乙酯。关于该实验的说法不正确的是
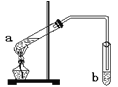
A. a试管中发生的反应是酯化反应,原理是乙酸脱去羟基、乙醇脱氢
B. b试管中所盛的试剂是NaOH
C. 反应后b中可以看到明显的分层,产物在上层
D. 试管b中的导管要在液面的稍上方,不能插入液面以下,是为了防止倒吸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在0.1mol/LCH3COOH溶液中存在如下电离平衡:CH3COOH![]() CH3COO-+H+对于该平衡,下列叙述正确的是( )
CH3COO-+H+对于该平衡,下列叙述正确的是( )
A. 加入水时,平衡向逆反应方向移动
B. 加入少量NaOH固体,平衡向正反应方向移动
C. 加入少量0.1mol·L-1 HCl溶液,溶液中c(H+)减小
D. 加入少量CH3COONa固体,平衡向正反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物A的结构为 , 下列有关说法正确的是
, 下列有关说法正确的是
A. 1 mol A能跟2 mol NaOH溶液反应
B. 能发生加聚反应
C. 不能发生分子内酯化反应
D. A分子中所有原子在同一平面上
查看答案和解析>>
科目:高中化学 来源: 题型:
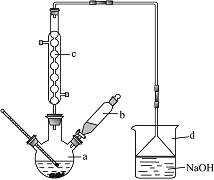
【题目】溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如下:
苯 | 溴 | 溴苯 | |
密度/g·cm-3 | 0.88 | 3.10 | 1.50 |
沸点/℃ | 80 | 59 | 156 |
水中溶解度 | 微溶 | 微溶 | 微溶 |
按下列合成步骤回答问题:
(1)在a中加入15mL无水苯和少量铁屑。在b中小心加入4.0mL液态溴。向a中滴入几滴溴,有白色烟雾产生,是因为生成了______气体。该反应为_______(填“吸热”或“放热”)反应,冷却水流向是_____________(填“上进下出”或“下进上出”),继续滴加至液溴滴完。其中仪器c的名称是________,其作用是:__________________________________。装置d的作用是:_____________________________________________________;烧瓶中发生的有机反应的方程式为:_______________________________________________。
(2)液溴滴完后,经过下列步骤分离提纯:
①向a中加入10mL水,然后过滤除去未反应的铁屑;
②滤液依次用10mL水、8mL 10%的NaOH溶液、10mL水洗涤。洗涤、分离有机和无机试剂,需要用到的仪器是:_____________。第一次水洗除去大部分的HBr;用NaOH溶液洗涤的作用是______________;第二次水洗的目的是:____________;每一次洗涤,有机层从_________(填“下口放出”或“上口倒出”),棕黄色的溴苯经过提纯后恢复为无色。
③向分出的粗溴苯中加入少量的无水氯化钙,静置、过滤。加入氯化钙的目的是_____________。
(3)经以上分离操作后,粗溴苯中还含有的主要杂质苯,要进一步提纯,下列操作中必须的是____(填入正确选项前的字母)。
A.蒸馏 B.渗析 C.分液 D.萃取
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨工业在国民生产中有重要意义。回答下列问题:
(1)在恒温恒压条件下,在装置中发生合成氨的反应N2(g)+3H2(g)![]() 2NH3(g) ,下列说法正确的是(______)(填字母)
2NH3(g) ,下列说法正确的是(______)(填字母)
A.气体体积不再变化,则已经平衡
B.气体密度不再变化,可能尚未达到平衡
C.平衡后,向装置中通入氩气,压强不变,平衡不移动
D.平衡后,压缩体积,则生成更多的氨气
E.催化剂可以提高生产氨气的产率
(2)N2(g)+3H2(g)![]() 2NH3(g) ΔH = —92.0 kJ·mol-1,恒容时,体系中各物质浓度随时间变化曲线如图1所示。
2NH3(g) ΔH = —92.0 kJ·mol-1,恒容时,体系中各物质浓度随时间变化曲线如图1所示。
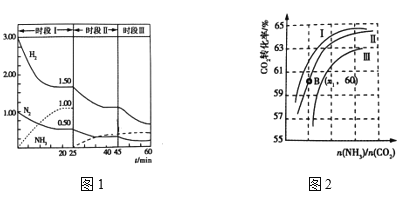
①25min时采取的措施是 _______________________________ 。
②三个时间段分别是改变一个条件引起的平衡移动,平衡时平衡常数KⅠ、KⅡ、KⅢ的大小关系 __________________。
③在实际工业生产中和①中措施的目的相同的其他措施还有 _____________________(写两条)
(3)①合成氨工艺生产中间环节产生的CO会导致催化剂中毒,常用铜液[醋酸二氨合铜(Ⅰ)、氨水]吸收,Cu(NH3)2Ac + CO + NH3 ![]() [Cu(NH3)3CO]Ac ΔH<0。简述吸收CO及铜液再生的操作步骤(注明吸收和再生的条件)__________________________________________________________________________
[Cu(NH3)3CO]Ac ΔH<0。简述吸收CO及铜液再生的操作步骤(注明吸收和再生的条件)__________________________________________________________________________
②如果要提高上述反应的反应速率,且提高氨气的转化率,可采取的措施有(______)
a. 加压 b.加催化剂 c.升温 d.及时移走产物
(4)①用氨气制取尿素[CO(NH2)2]的反应为:2NH3(g)+CO2(g)![]() CO(NH2)2(l)+H2O(g) ΔH<0。已知该反应的v (正)=k(正)c2(NH3)c(CO2),v (逆)=k(逆)c(H2O),k(正)和k(逆)为速率常数,则平衡常数K与k(正)、k(逆)的关系式是__________________
CO(NH2)2(l)+H2O(g) ΔH<0。已知该反应的v (正)=k(正)c2(NH3)c(CO2),v (逆)=k(逆)c(H2O),k(正)和k(逆)为速率常数,则平衡常数K与k(正)、k(逆)的关系式是__________________
②实际生产中,原料气带有水蒸气,图2表示CO2转化率与氨碳比![]() 、水碳比
、水碳比![]() 的变化关系。
的变化关系。
a. 曲线Ⅰ、Ⅱ、Ⅲ对应的水碳比![]() 最大的是_______________。
最大的是_______________。
b.测得B点氨的转化率为40%,则X1= _________________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙烯是重要有机化工原料。结合以下路线回答:
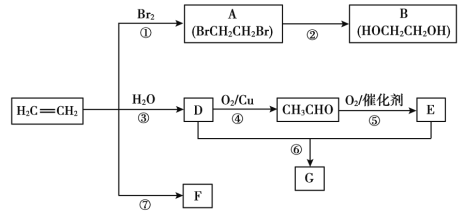
已知:2CH3CHO + O2催化剂,加热2CH3COOH
(1)反应①的化学方程式是_______。
(2)B的官能团是_______。
(3)F是一种高分子,可用于制作食品袋,其结构简式为_______。
(4)G是一种油状、有香味的物质,有以下两种制法。
制法一:实验室用D和E反应制取G,装置如图所示。

i.反应⑥的化学方程式是______,反应类型是_____。
ii.分离出试管乙中油状液体用到的主要仪器是_______。
制法二:工业上用CH2=CH2和E直接反应获得G。
iii.反应类型是___。
iv.与制法一相比,制法二的优点是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以冶铝的废弃物铝灰为原料制取超细α-氧化铝,既降低环境污染又可提高铝资源的利用率。已知铝灰的主要成分为Al2O3(含少量杂质SiO2、FeO、Fe2O3),其制备实验流程如下:
(1)铝灰中氧化铝与硫酸反应的化学方程式为 。
(2)用图中“滤渣”和NaOH焙烧制备硅酸钠,可采用的装置为 (填选项编号)。
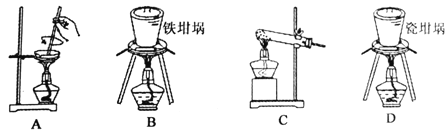
(3)在实验流程中,加30%的H2O2溶液发生的离子反应方程式为 。
(4)验证“沉铁”后,溶液中是否还含有铁离子的操作方法为 。
(5)若用调节pH溶液“沉铁”,则得到Fe(OH)3,已知:25℃时,Ksp[Fe(OH)3]=4.0×10-38,则该温度下反应Fe3++3H2O![]() Fe(OH)3+3H+的平衡常数为 。
Fe(OH)3+3H+的平衡常数为 。
(6)煅烧硫酸铝铵晶体,发生的主要反应为:4[NH4Al(SO4)2·12H2O]![]() 2Al2O3+ 2NH3↑+ N2↑+ 5SO3↑+ 3SO2↑+ 53H2O,将产生的气体通过下图所示的装置。
2Al2O3+ 2NH3↑+ N2↑+ 5SO3↑+ 3SO2↑+ 53H2O,将产生的气体通过下图所示的装置。
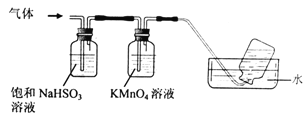
①集气瓶中收集到的气体是 (填化学式)。
②KMnO4溶液褪色,发生的离子反应方程式为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com