
【题目】以冶铝的废弃物铝灰为原料制取超细α-氧化铝,既降低环境污染又可提高铝资源的利用率。已知铝灰的主要成分为Al2O3(含少量杂质SiO2、FeO、Fe2O3),其制备实验流程如下:
(1)铝灰中氧化铝与硫酸反应的化学方程式为 。
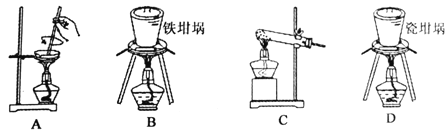
(2)用图中“滤渣”和NaOH焙烧制备硅酸钠,可采用的装置为 (填选项编号)。
(3)在实验流程中,加30%的H2O2溶液发生的离子反应方程式为 。
(4)验证“沉铁”后,溶液中是否还含有铁离子的操作方法为 。
(5)若用调节pH溶液“沉铁”,则得到Fe(OH)3,已知:25℃时,Ksp[Fe(OH)3]=4.0×10-38,则该温度下反应Fe3++3H2O![]() Fe(OH)3+3H+的平衡常数为 。
Fe(OH)3+3H+的平衡常数为 。
(6)煅烧硫酸铝铵晶体,发生的主要反应为:4[NH4Al(SO4)2·12H2O]![]() 2Al2O3+ 2NH3↑+ N2↑+ 5SO3↑+ 3SO2↑+ 53H2O,将产生的气体通过下图所示的装置。
2Al2O3+ 2NH3↑+ N2↑+ 5SO3↑+ 3SO2↑+ 53H2O,将产生的气体通过下图所示的装置。
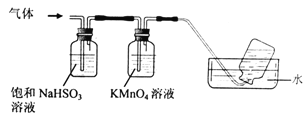
①集气瓶中收集到的气体是 (填化学式)。
②KMnO4溶液褪色,发生的离子反应方程式为 。
【答案】(1)Al2O3+ 3H2SO4= Al2(SO4)3+ 3H2O(2分)(2)B(1分)
(3)2Fe2++H2O2+2H+= 2Fe3++2H2O(2分)
(4)静置,溶液澄清后,继续向上层清液中滴加K4[Fe(CN)6]溶液,若无现象,则溶液中不含有铁元素,反之,则有。(其它合理答案)(2分)
(5)2.5×10-5(2分)
(6)①N2(1分)②2MnO4- +5SO2+2H2O=2Mn2++5SO42-+4H+(2分)
【解析】试题(1)铝灰中氧化铝与硫酸反应的化学方程式为Al2O3+ 3H2SO4= Al2(SO4)3+ 3H2O;
(2)FeO、Fe2O3和氧化铝溶于酸,二氧化硅不溶形成滤渣,二氧化硅和NaOH焙烧制备硅酸钠,不能用玻璃和瓷质容器,所以可采用的装置为B;
(3)过滤后滤液中存在Fe2+、Fe3+,Al3+,加30%的H2O2溶液会氧化Fe2+,离子反应方程式为2Fe2++H2O2+2H+=2Fe3++2H2O;
(4)在被氧化后的溶液中加入了K4[Fe(CN)6]溶液把Fe3+沉淀,验证溶液中是否还含有铁离子的操作方法为静置,待溶液澄清后,继续向上层清液中滴加K4[Fe(CN)6]溶液,若无现象,则溶液中不含铁元素,反之则有;
(5)Ksp[Fe(OH)3]=4.0×10-38,即c(Fe3+)c3(OH-)=4.0×10-38,该温度下反应Fe3++3H2O![]() Fe(OH)3+3H+的平衡常数K=c3(H+)/c(Fe3+)=Kw3/c(Fe3+)c3(OH-)=(10-14)3/4.0×10-38=2.5×10-5;
Fe(OH)3+3H+的平衡常数K=c3(H+)/c(Fe3+)=Kw3/c(Fe3+)c3(OH-)=(10-14)3/4.0×10-38=2.5×10-5;
(6)①通过饱和亚硫酸氢钠溶液除去氨气、三氧化硫,通过高锰酸钾溶液除去二氧化硫气体,故收集的气体为N2;②KMnO4溶液与二氧化硫反应,离子反应方程式为2MnO4-+5SO2+2H2O=2Mn2++5SO42-+4H+。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】某物质灼烧时,焰色反应为黄色,下列判断中正确的是
A. 该物质一定是钠的化合物 B. 该物质一定含钠元素
C. 可以确定该物质中不含钾元素 D. 该物质一定是金属钠
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒温恒压下,向密闭容器中充入4mol A和2 mol B,发生如下反应:2A(g)+B(g)![]() 2C(g)ΔH<0。2min后,反应达到平衡,生成C为1.6mol。则下列分析正确的是()
2C(g)ΔH<0。2min后,反应达到平衡,生成C为1.6mol。则下列分析正确的是()
A. 若反应开始时容器体积为2L,则Vc=0.4molL-1min-1
B. 若在恒压绝热条件下反应,平衡后nc<1.6mol
C. 若2min后,向容器中再投入2mol A和1 mol B, B的转化率变大
D. 若该反应在恒温恒容下进行,放出热量将增加
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对物质进行分类,有利于我们的学习。下列物质的分类正确的是
选项 | 酸 | 碱 | 盐 | 非电解质 |
A | H2SO4 | NaOH | NaHCO3 | BaSO4 |
B | HCl | C2H5OH | NaCl | CO2 |
C | HNO3 | Ba(OH)2 | BaCO3 | CH4 |
D | CH3COOH | KOH | Na2S | Cl2 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应方程式是化学学习的基本工具,本学期在化学反应速率与化学平衡章节学过几个重要的方程式,请你按要求写出:
(1)硫代硫酸钠与稀硫酸溶液反应的离子方程式:________________。
(2)在重铬酸钾的硫酸溶液中的Cr2O72—与CrO42—之间转化的离子方程式:________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】葡萄酒中的酒精是葡萄果实中的糖发酵后的产物(C6H12O6![]() 2CH3CH2OH+2CO2↑)。
2CH3CH2OH+2CO2↑)。
Ⅰ、已知:实验室制乙烯原理为CH3CH2OH![]() CH2=CH2↑+H2O,产生的气体能使Br2的四氯化碳溶液褪色,甲、乙同学用下列实验验证。(气密性已检验,部分夹持装置略)。
CH2=CH2↑+H2O,产生的气体能使Br2的四氯化碳溶液褪色,甲、乙同学用下列实验验证。(气密性已检验,部分夹持装置略)。

实验操作和现象:
操 作 | 现 象 |
点燃酒精灯,加热至170℃ | Ⅰ:A中烧瓶内液体渐渐变黑 |
…… | |
实验完毕,清洗烧瓶 | Ⅲ:A中烧瓶内附着少量黑色颗粒状物,有刺激性气味逸出 |
(1)溶液“渐渐变黑”,说明浓硫酸具有 性。
(2)分析,甲认为是C2H4,乙认为不能排除SO2的作用。
①根据甲的观点,使B中溶液褪色反应的化学方程式是 ;
②乙根据现象认为实验中产生的SO2和 ,使B中有色物质反应褪色。
③为证实各自观点,甲、乙重新实验,设计与现象如下:
甲:在A、B间增加一个装有某种试剂的洗气瓶;现象:Br2的CCl4溶液褪色。
乙:用下列装置按一定顺序与A连接:(尾气处理装置略)

现象:C中溶液由红棕色变为浅红棕色时,E中溶液褪色。
请回答下列问题:
a.甲设计实验中A、B间洗气瓶中盛放的试剂是 ;乙设计的实验D中盛放的试剂是 ,装置连接顺序为 。
b.能说明确实是SO2使E中溶液褪色的实验是 。
c.乙为进一步验证其观点,取少量C中溶液,加入几滴BaCl2溶液,振荡,产生大量白色沉淀,浅红棕色消失,发生反应的离子方程式是 。由此可得出的干燥的SO2不能使Br2的四氯化碳溶液褪色
Ⅱ、葡萄酒中常用Na2S2O5做抗氧化剂。
(3)0.5molNa2S2O5溶于水配成1L溶液,该溶液的pH=4.5。溶液中部分微粒浓度随溶液酸碱性变化如图所示。写出Na2S2O5溶于水时发生的化学方程式 。

(4)已知:Ksp[BaSO4]=1×10-10,Ksp[BaSO3]=5×10-7。把部分被空气氧化的该溶液的pH调为10,向溶液中滴加BaCl2溶液使SO42-沉淀完全[c(SO42-)≤1×10-5mol·L-1],此时溶液中c(SO32-)≤ mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科学家研发了一种室温下“可呼吸”的Na—CO2二次电池。将NaClO4溶于有机溶剂作为电解液,钠和负载碳纳米管的镍网分别作为电极材料,电池的总反应为:3CO2+4Na![]() 2Na2CO3+C。下列说法错误的是
2Na2CO3+C。下列说法错误的是

A. 放电时,ClO4-向负极移动
B. 充电时释放CO2,放电时吸收CO2
C. 放电时,正极反应为:3CO2+4e =2CO32-+C
D. 充电时,正极反应为:Na++e=Na
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知有以下物质相互转化,试回答:

(1)写出B的化学式_______________,D的化学式_______________________。
(2)写出由B转变成E的化学方程式_____________________________。
(3)写出用KSCN鉴别G溶液的离子方程式______________;向G溶液加入A的有关离子反应方程式___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物F是合成药物“银屑灵”的中间体,其合成流程如下:
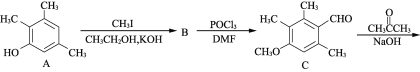
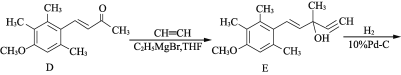
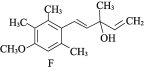
(1) 化合物C中含氧官能团的名称为________、________。
(2) D→E的反应类型为________________,C→D经历了先加成再消去的反应过程,请写出中间产物的结构简式:___________________________。
(3) 化合物B的分子式为C10H14O,写出B的结构简式:________________。
(4) 写出同时满足下列条件的C的一种同分异构体的结构简式:____________________。
①不能发生银镜反应;
②能发生水解反应,其水解产物之一能与FeCl3溶液发生显色反应;
③分子中有4种不同化学环境的氢。
(5) 已知: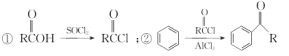 以苯甲醇、乙醛为原料制备
以苯甲醇、乙醛为原料制备![]() ,写出相应的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)_________________________ 。
,写出相应的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)_________________________ 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com