
【题目】已知有以下物质相互转化,试回答:

(1)写出B的化学式_______________,D的化学式_______________________。
(2)写出由B转变成E的化学方程式_____________________________。
(3)写出用KSCN鉴别G溶液的离子方程式______________;向G溶液加入A的有关离子反应方程式___________。
【答案】FeCl2KClFeCl2 + 2KOH =Fe(OH)2↓ + 2KClFe3+ +3SCN- =Fe(SCN)32Fe3+ +Fe =3Fe2+
【解析】
仔细分析转化关系,由白色沉淀E在空气中转化为红褐色沉淀F可以推出,E为Fe(OH)2,F为Fe(OH)3,氢氧化铁与盐酸反应生成氯化铁和水,则G是FeCl3;由D溶液加硝酸酸化的硝酸银溶液产生白色沉淀H,可推出H为AgCl,溶液焰色反应呈紫色,则D中含有K+,故D为KCl,B中含有Fe2+和Cl-,C溶液为KOH溶液,A应为Fe,Fe与盐酸反应生成氯化亚铁和氢气符合转化关系,以此分析解答。
(1)通过以上分析可知B为氯化亚铁,化学式为FeCl2,D为氯化钾,化学式为KCl,
故答案为:FeCl2 ;KCl;
(2)由B转变成E是氯化亚铁和氢氧化钾反应生成氢氧化亚铁沉淀和氯化钾,化学方程式为FeCl2 + 2KOH =Fe(OH)2↓ + 2KCl,
故答案为:FeCl2 + 2KOH =Fe(OH)2↓ + 2KCl;
(3)G溶液FeCl3溶液,含有Fe3+,加入KSCN溶液出现血红色,用于鉴别FeCl3溶液,离子方程式Fe3+ +3SCN- =Fe(SCN)3;
向FeCl3溶液加入Fe生成FeCl2,离子反应方程式为2Fe3+ +Fe =3Fe2+,
故答案为:Fe3+ +3SCN- =Fe(SCN)3 ;2Fe3+ +Fe =3Fe2+。


科目:高中化学 来源: 题型:
【题目】乙烯是重要有机化工原料。结合以下路线回答:
已知:2CH3CHO + O2催化剂,加热2CH3COOH
(1)反应①的化学方程式是_______。
(2)B的官能团是_______。
(3)F是一种高分子,可用于制作食品袋,其结构简式为_______。
(4)G是一种油状、有香味的物质,有以下两种制法。
制法一:实验室用D和E反应制取G,装置如图所示。

i.反应⑥的化学方程式是______,反应类型是_____。
ii.分离出试管乙中油状液体用到的主要仪器是_______。
制法二:工业上用CH2=CH2和E直接反应获得G。
iii.反应类型是___。
iv.与制法一相比,制法二的优点是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以冶铝的废弃物铝灰为原料制取超细α-氧化铝,既降低环境污染又可提高铝资源的利用率。已知铝灰的主要成分为Al2O3(含少量杂质SiO2、FeO、Fe2O3),其制备实验流程如下:
(1)铝灰中氧化铝与硫酸反应的化学方程式为 。
(2)用图中“滤渣”和NaOH焙烧制备硅酸钠,可采用的装置为 (填选项编号)。
(3)在实验流程中,加30%的H2O2溶液发生的离子反应方程式为 。
(4)验证“沉铁”后,溶液中是否还含有铁离子的操作方法为 。
(5)若用调节pH溶液“沉铁”,则得到Fe(OH)3,已知:25℃时,Ksp[Fe(OH)3]=4.0×10-38,则该温度下反应Fe3++3H2O![]() Fe(OH)3+3H+的平衡常数为 。
Fe(OH)3+3H+的平衡常数为 。
(6)煅烧硫酸铝铵晶体,发生的主要反应为:4[NH4Al(SO4)2·12H2O]![]() 2Al2O3+ 2NH3↑+ N2↑+ 5SO3↑+ 3SO2↑+ 53H2O,将产生的气体通过下图所示的装置。
2Al2O3+ 2NH3↑+ N2↑+ 5SO3↑+ 3SO2↑+ 53H2O,将产生的气体通过下图所示的装置。
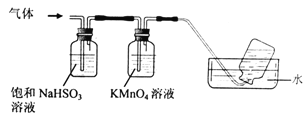
①集气瓶中收集到的气体是 (填化学式)。
②KMnO4溶液褪色,发生的离子反应方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列无色溶液中,能大量共存的离子组是( )
A.Cu2+、H+、I-、SO42-B.Na+、Ba2+、NO3-、OH-
C.K+、Mg2+、CO32-、Cl-D.K+、H+、Cl-、MnO4-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用乙酸和乙醇在浓硫酸作用下制取乙酸乙酯的装置如图。下列说法正确的是
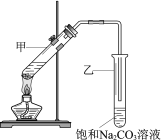
A. 向甲试管中先加浓硫酸,再加乙醇和乙酸
B. 乙试管中导管不伸入液面下,是为了防止倒吸
C. 加入过量乙酸,可使乙醇完全转化为乙酸乙酯
D. 实验完毕,可将乙酸乙酯从混合物中过滤出来
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请用序号填空:
①13C与14C ②正丁烷与异丁烷
③CH3CH3与CH3CH2CH3 ④
(1)属于同位素的是______;
(2)属于同系物的是______;
(3)属于同分异构体的是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电能是现代社会应用最广泛的能源之一。
(1)某原电池装置如图所示。

其中,Zn电极为原电池的______极(填“正”或“负”),电极反应式是______。Cu电极上发生的反应属于______(填“氧化”或“还原”) 反应,当铜表面析出4.48 L氢气(标准状况)时,导线中通过了______ mol电子。
(2)下列反应通过原电池装置,可实现化学能直接转化为电能的是______(填序号)。
①CaO+H2O=Ca(OH)2
②2H2+O2 =2H2O
③2FeCl3+Cu=CuCl2+2FeCl2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝石墨双离子电池是一种全新低成本、高效电池。原理为:A1Li+Cx(PF6)![]() Al+xC+Li++PF6-。电池结构如图所示。下列说法正确的是
Al+xC+Li++PF6-。电池结构如图所示。下列说法正确的是

A. 放电时,外电路中电子向铝锂电极移动
B. 放电时,正极反应为Cx(PF6)+e-=xC+PF6-
C. 充电时,应将铝石墨电极与电源负极相连
D. 充电时,若电路中通过1 mol电子,阴极质量增加9 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一小块钠投入盛10mL饱和澄清石灰水的烧杯中,不可能观察到的现象是
A. 钠熔成小球并在液面上游动 B. 有气体生成
C. 溶液底部有银白色金属物质生成 D. 溶液变浑浊
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com